- ja Change Region
- Global Site
ライブセルイメージング
細胞生物学において、ライブセルイメージング、特に蛍光イメージングは重要です。ライブセル蛍光イメージングにより、特定の生体分子の動態や相互作用を長時間にわたって観察できます。遺伝子発現などの標識として蛍光タンパク質が開発されたことをはじめ、過去数十年間にわたる数多くの技術革新により、ライブイメージングの利便性が向上しました。一般的に、ライブセルイメージングには、培地を満たした培養容器を置くのに適した倒立顕微鏡が使用されます。
ライブセルイメージングに関連する製品
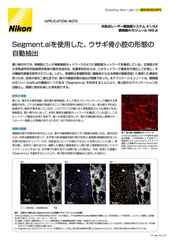
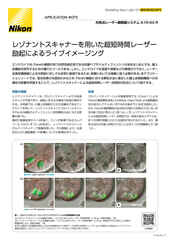
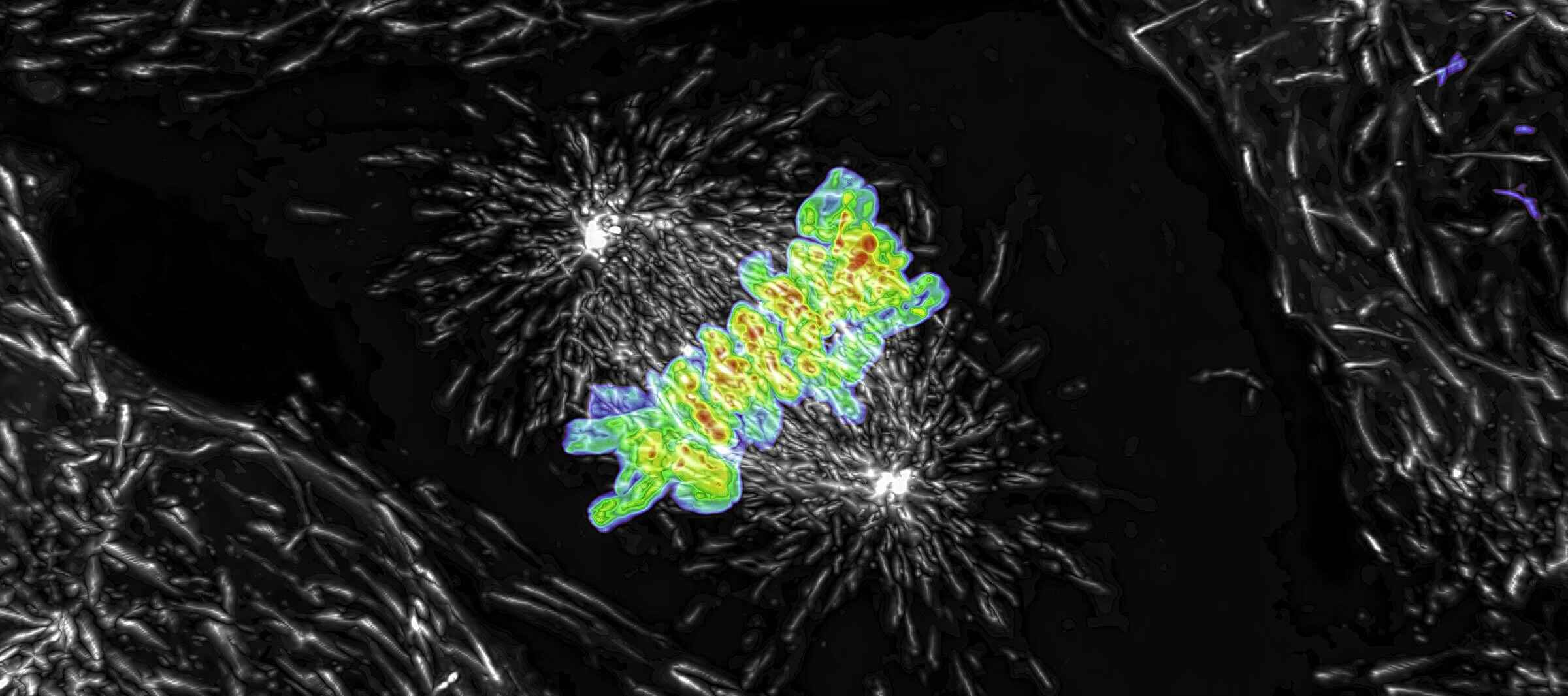
Zスタック画像取得した有糸分裂の画像。AX Rレゾナントスキャナーを使用。毎秒15 フレーム、2048 x 1024画素で取得。対物レンズ:CFI プランアポクロマート Lambda 60X Oil(NA 1.4)
電動倒立顕微鏡Ti2-Eは、ライブセルイメージングに適した顕微鏡であり、ここで紹介するすべての共焦点および超解像システムと組み合わせることができます。自動焦点維持装置パーフェクトフォーカスシステム(PFS)により、ガラスとプラスチックのいずれの培養容器でも、焦点ずれのない長時間のライブセルイメージングが行えます。水浸対物レンズにはウォーターイマージョンディスペンサーも使用できます。
モジュール照明システムTi2-LAPPを使用することで、一台の顕微鏡に、TIRF、光刺激、落射蛍光、超解像など最大5つのモジュールを同時に搭載できます。一度に複数のTIRFモジュールを装着でき、レーザーごとに最適なTIRF入射角度を調節して、同時多色イメージングが行えます。
自動培養顕微鏡イメージングシステムBioPipeline LIVEのプラットフォームとして電動倒立顕微鏡Ti2-Eを採用。インキュベーターと密閉されたイメージング空間により、安定した培養環境を維持できます。ウェルプレートを顕微鏡ステージへ自動搬送でき、最大44枚のウェルプレートを使用したハイコンテントイメージングが行えます。
共焦点レーザー顕微鏡システムAX / AX Rは、ポイントスキャン共焦点顕微鏡です。AX Rは、毎秒30フレーム(512 x 512画素)で高速取得できるレゾナントスキャナーを搭載しています。また、共焦点イメージングの主なノイズ源であるショットノイズ成分を自動的に除去するDenoise.aiも使用できます。スピニングディスク共焦点システムは、ライブセルイメージングにおける評価の高い手法です。ピンホールの間隔が広いため、隣接するピンホール間の信号クロストークを低減でき、散乱サンプルの深部イメージングが可能です。このため、オルガノイドなどの厚みのあるサンプルのイメージングに適しています。
デジタル倒立顕微鏡ECLIPSE Jiでは、Ti2-Eと同様のパーフェクトフォーカスシステム(PFS)を活用することが可能です。さらに、ステージトップインキュベータを接続することで、培養環境と同じCO2濃度、湿度、温度を保つことができ、長時間のライブセルイメージングが可能になります。また、ECLIPSE JiにAX / AX Rを接続することで、上述の高速取得やDenoise.aiを用いたショットノイズの除去、厚みのあるサンプルのイメージングにも対応できます。
●:使用可能 , ⚬:オプション
| 倒立顕微鏡ECLIPSE Ti2-E (落射蛍光イメージング)* |
自動培養顕微鏡イメージングシステムBioPipeline LIVE | レゾナント共焦点レーザー顕微鏡システムAX R | Ti2-LAPP E-TIRF照明装置によるTIRFイメージング | |
|---|---|---|---|---|
| 相対的最大観察深度 | ~ 5 μm ~ 15 – 25 μm (デコンボリューション時) |
〜5μm オプションの共焦点システムとの組み合わせにより、さらに深い観察深度が可能 |
~ 100 – 500 μm | ~ 100 – 300 nm |
| ビデオレートでの撮影 | ● |
● (カメラやディスク回転速度による制限あり) |
可能(30 fps:512 x 512スキャン) | ● (カメラやディスク回転速度による制限あり) |
| 視野数 | 対角25mm(円形) | 対角25mm(円形) | 対角25mm(正方形) | 対角10 mm(円形) |
| イメージング方法 | ECLIPSE Ti2-E | BioPipeline LIVE | AX R | Ti2-LAPP E-TIRF |
| 明視野 | yes | no | no | no |
| ポイントスキャン共焦点 | no | optional | yes | no |
| スピニングディスク共焦点 | no | optional | no | no |
| 暗視野 | yes | no | no | no |
| 微分干渉(DIC) | yes | no | no | no |
| ニコンアドバンストモジュレーションコントラスト(NAMC) | yes | no | no | no |
| 位相差 | yes | no | no | no |
| 全反射照明蛍光(TIRF) | no | no | no | yes |
| ボリュームコントラスト | yes | no | no | no |
| 落射蛍光 | yes | no | no | no |
| 使用可能な顕微鏡 | ECLIPSE Ti2-E | BioPipeline LIVE | AX R | Ti2-LAPP E-TIRF |
| 倒立顕微鏡ECLIPSE Ti2-E | no | yes | yes | yes |
| デジタル倒立顕微鏡 ECLPSE Ji | no | no | yes | no |
| 正立顕微鏡ECLIPSE Ni-E | no | no | yes | no |
| 正立顕微鏡FN1 | no | no | yes | no |
*この行は、Ti2-Eを落射蛍光イメージングにのみ使用する場合を記載しています。Ti2-Eは、表に記載された他のシステムとの併用が推奨される顕微鏡です。
アプリケーションノート
ライブセルイメージングについて
ライブセルイメージングの技術と科学
ニコンの自動培養顕微鏡イメージングシステムBioPipeline LIVEは、インキュベーターとシームレスに接続し、完全に密閉されたイメージング空間を実現したシステムです。
ニコンのシリコーンオイル浸シリーズ対物レンズは、高いNAと長い作動距離を持ち、温度による収差の補正環を備えています。
ライブセルイメージングでは、慎重に取得条件のバランスをとる必要があります。その目的は、取得するデータを必要最小限にし、サンプルへの影響を抑えるためです。より高いS/N比の画像を取得するためには、照明強度を上げたりカメラの露光時間を延ばしたりしたくなりますが、光毒性により、サンプルの生理学的な完全性や持続的な生存能力が損なわれる可能性があることを理解する必要があります。さらに、光退色により、実験の全過程で各蛍光色素から抽出できる光子の数が実質的に制限されてしまいます。
ライブイメージングの実験で重要となるのは環境条件の制御、すなわち実験対象に対する適切な気体混合比、温度、湿度を維持することです。これは、ステージ上に置く小さな培養器か、顕微鏡の大部分を覆う大きな格納箱のいずれかを使用することで実現できます。ニコンの顕微鏡用に設計されたステージトップ培養器と大型顕微鏡格納箱はいずれも、サードパーティのトップメーカーから提供されています。
その他の検討事項として、対物レンズの選択があります。開口数(NA)の高い油浸対物レンズは、扁平細胞のカバーガラス近傍を撮影するのに適していますが、画像がサンプルの深部になるほど球面収差の問題が大きくなります。これは、ガラスや液浸オイルと比べて、細胞や培地の屈折率(RI)が低いことが原因です。より深い3Dイメージングには、イメージング環境の屈折率により近い屈折率を持つ、水やシリコーンオイルなどの浸液を使用する対物レンズを選択することが推奨されます。
CFIアポクロマートLambda S対物レンズシリーズには、1.27(弊社発表値)という、水浸対物レンズとしては最も高いNAを持つCFIプランアポクロマートIR 60XC WIなど、数多く水浸対物レンズが揃っています。ニコンは近年、シリコーンオイル浸シリーズの対物レンズも発表しました。シリコーンオイルは、屈折率が細胞環境に非常に近い約1.4であるうえ、水浸対物レンズよりも高いNAを実現できます。これらの対物レンズは、オルガノイドなどの三次元培養システムのイメージングに適しています。
生細胞への光毒性と光退色を低減

ハードウェアトリガーにより、全体の実験時間を大幅に改善できます。この大部分の例において、カメラの露光時間はカメラの読み取り時間よりも長くなっています。
a 最後の行は、カメラの露光時間が読み取り時間と同じで、カメラがオーバーラップ(デューティサイクル100%)モードで動作できた場合の比較を示しています。
蛍光を使用したイメージング技術では強力な光照射が必要とされますが、これは特に高エネルギーの波長の場合、基本的に細胞に有害となります。このため、赤帯域から近赤外帯域までの蛍光色素の使用が推奨されます。一方で、EGFPなどの一般的な緑帯域の蛍光色素も、幅広い多色イメージングにおいて依然として有効であり、引き続き使用することに問題はありません。
多くの顕微鏡は、ソフトウェアにより電動デバイスと連携しています。しかし、コンピュータークロックが比較的不正確であるうえ、デバイス状態のチェックやコールバックが必要となることから、動作が多少遅くなることがあります。それに対して、ハードウェアによるトリガーは、高精度のカメラピクセルクロックを使用して、コールバックをバイパスしながらデバイスを調整できるため、システムを高速化し、光毒性を最小限に抑えることができます。ピエゾZステージやレーザー/ LED照明装置、I / O通信機能を備えたカスタムデバイスなどをトリガーすることが可能です。
トリガーによって、より複雑な照明パターンも可能になります。たとえば、ニコンの画像統合ソフトウェアNIS-Elementsを使用して、sCMOSカメラのすべてのピクセルが露光している(ローリングシャッターの効果を果たす)ときのみサンプルを照明することが可能です。これにより、継続照明や自走撮影の場合よりも、光毒性や光退色を低減できます。また、LEDやレーザー照明装置による露光の際に、マイクロ秒単位でパルス照明を行うことも可能です。このような短時間のパルス照明により、三重項状態に励起された蛍光色素が基底状態に戻るための時間を延長することができ、光退色の大きな要因を回避できます。
ディープラーニングを応用した人工知能により、ライブセルイメージングを改善
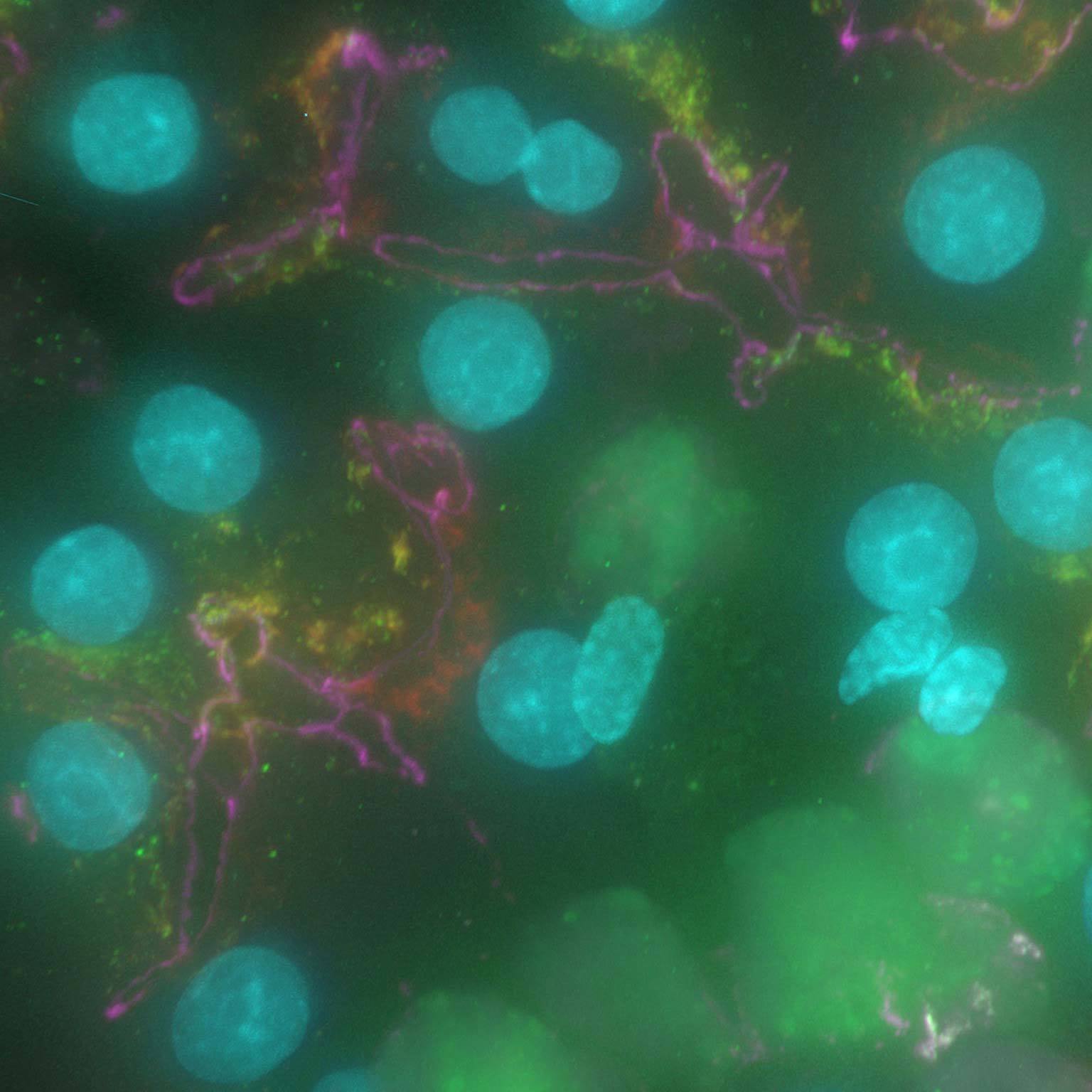
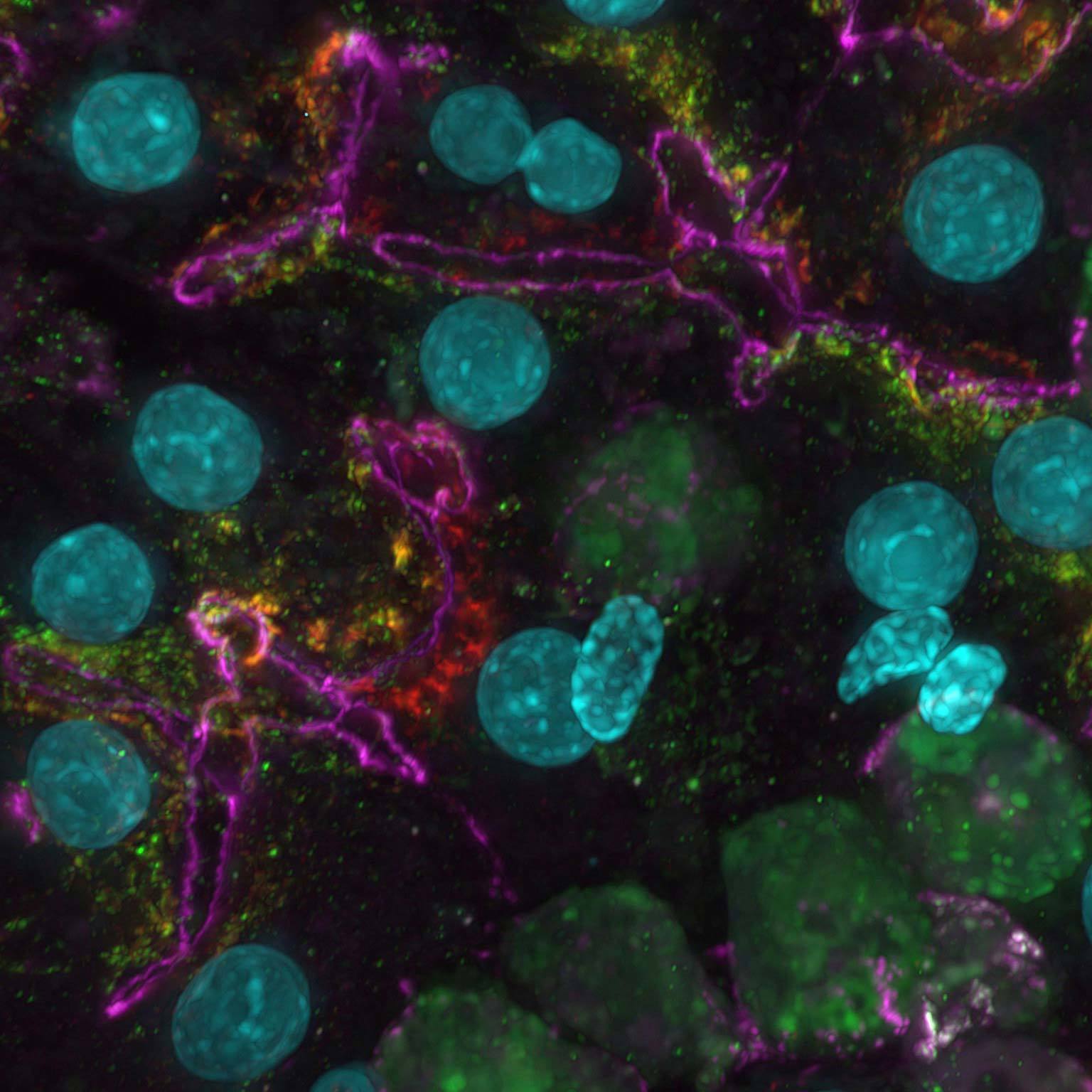
蛍光画像は、散乱光や焦点面以外からの光により不鮮明になることがありますが、AIを活用したツールにより、ノイズやぼやけた背景光を除去した高コントラスト画像を構築することができます。
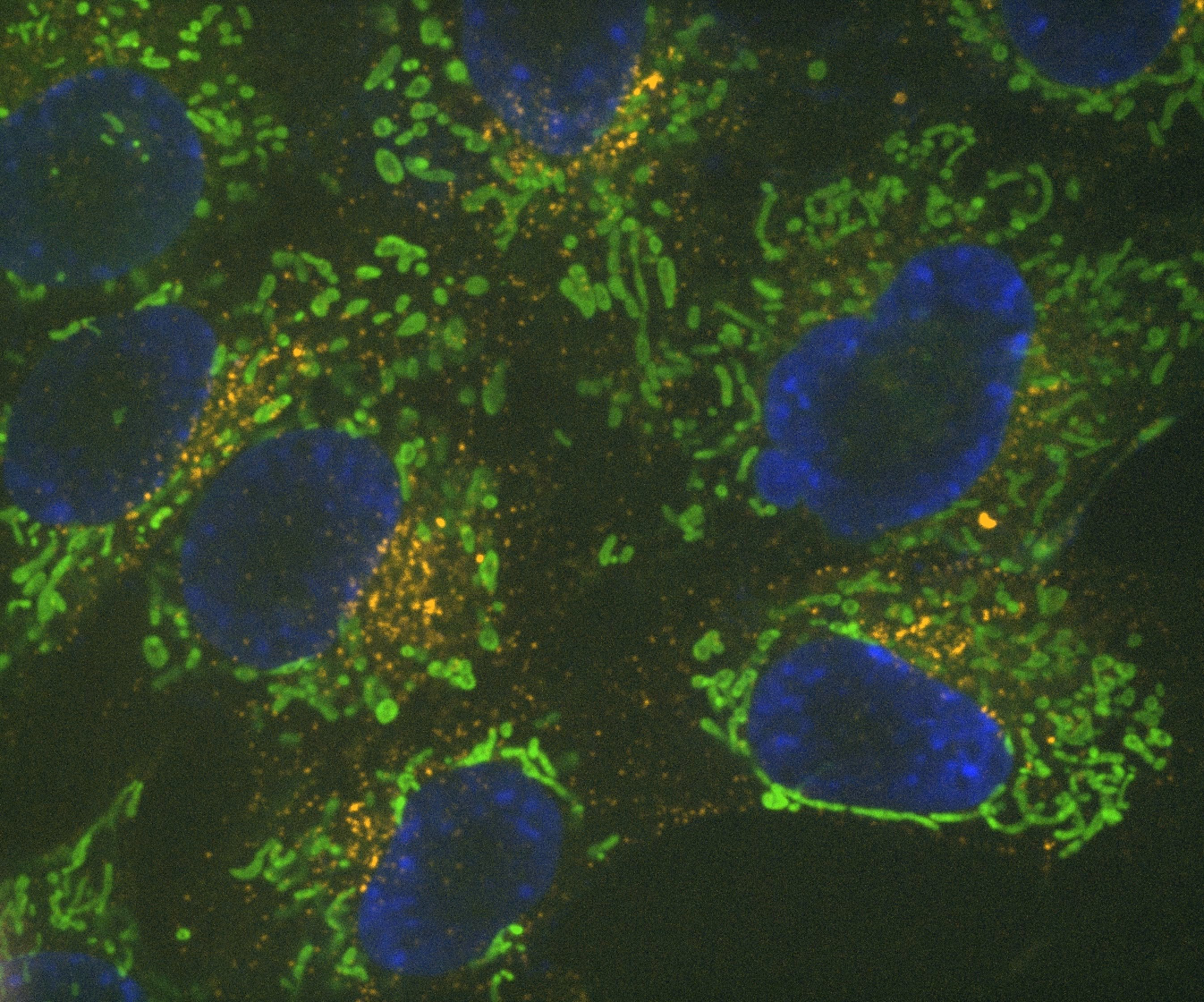
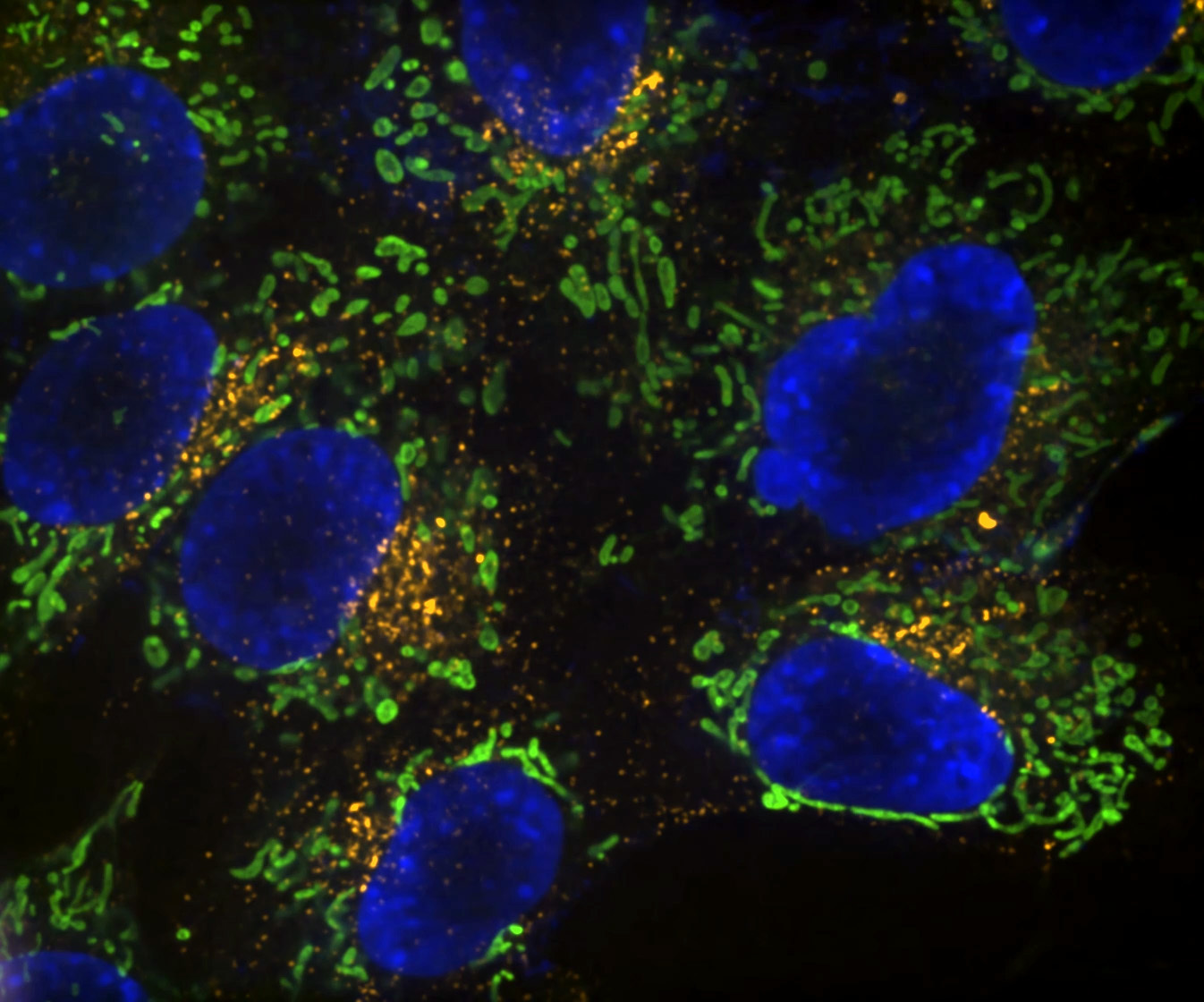
Denoise.aiは元の構造と輝度値はそのままに、画像のショットノイズ成分を除去できます。
人工知能(AI)の技術が顕微鏡イメージングに導入されることで、ライブセルイメージングにおける光毒性の低減に、新たな可能性が広がりました。ディープラーニングの利用は、生物標本の画像解析に適しています。ニコンは、ディープラーニングを活用したNIS-ElementsのNIS.aiモジュールを開発することにより、幅広い用途での安定した解析ソリューションを提供します。
Clarify.aiは、蛍光画像からぼやけた背景光を自動的に除去できます。学習済みのAIモジュールであるため、ユーザーが手動で調整する必要がなく、主観に左右されることがありません。Clarify.aiを使用すれば、システムの最大速度で取得した単一焦点面の蛍光画像を使用して、光学セクショニングを行うことができます。蛍光画像に3Dデコンボリューションを行う場合のように、複数の焦点面の画像を取得する必要はありません。
もう一つの学習済みモジュールであるDenoise.aiは、共焦点画像からショットノイズをリアルタイムに除去できます。これにより、露光時間を短縮することが可能です。また、ショットノイズはレゾナント画像の主なノイズ源であるため、Denoise.aiは共焦点顕微鏡AX Rで取得したレゾナント画像に使用することで、威力を発揮します。
Convert.aiは、通常であれば蛍光画像から検出される画像の特徴を、対応する明視野画像から、蛍光シグナルとして予測できます(たとえば、DIC画像からDAPI核染色パターンを予測するなど)。これにより、蛍光イメージングを行う必要がなくなるため、蛍光観察で必要とされる強い照明光を回避することができます。明視野観察はそもそも光毒性の低いイメージング手法です。
Enhance.aiは、蛍光シグナルの弱い画像から、高いS/N比の画像を構築することが可能です。これにより、S/N比を効果的に向上させて、光毒性や光退色の少ないイメージングを実現します。
研究に適した観察方法を選ぶには
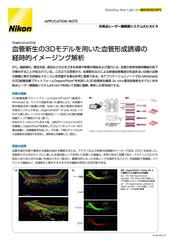
マウス腎糸球体の厚さ16µmの組織切片を、NIS-Elementsにより3Dデコンボリューションを行う前(a)と後(b)の蛍光画像
in vitroで培養された接着細胞など、比較的扁平な二次元サンプルであれば、蛍光イメージングでも十分かもしれません。しかし、デコンボリューションやClarify.aiの自動ノイズ除去と組み合わせて蛍光イメージングを行うことで、利用できる事例やサンプルの種類がさらに広がります。
共焦点イメージングは、厚さが約20 µm以上のサンプルのイメージングに必要ですが、わずか数µmの厚さのサンプルの高解像度イメージングにも有用です。また、オルガノイドやスフェロイドなど、さまざまな三次元細胞培養システムのイメージングに使用できます。
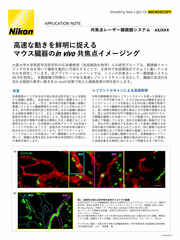
ポイントスキャン共焦点イメージングは、最大数百µmという高深度のイメージングが可能です。共焦点レーザー顕微鏡システムAX Rに搭載されたレゾナントスキャナーは、ビデオレートでのイメージングが可能であり、Denoise.aiと組み合わせることにより、ショットノイズの除去がリアルタイムで行えます。AX Rはピンホールを連続的に調整可能なため、対応するどの対物レンズを使用した場合も、光学セクショニングや解像度を最適化できます。
全反射照明蛍光(TIRF)観察は、細胞とカバーガラスとの界面から数百nm以内で発生する細胞の特徴のみを観察できる、光学セクショニング技術です。これにより、S/N比を改善させ、レーザー強度を抑えて細胞の活性を維持し、イメージング速度を向上することが可能です。ニコンのCFI Apochromat TIRFシリーズの対物レンズには、1.49という非常に高いNAを持つものがあります。
蛍光イメージングは、異なる分子のターゲットを複合的に検出できる有力な手法ですが、位相差や微分干渉(DIC)などの観察手法は、きわめて低い光毒性で詳細な細胞画像を取得できます。これらの手法は、必要な分子特異性が不足することがありますが、実験中の細胞の活性を確認するために、明視野画像も時々取得することをお勧めします。
用語解説
- イメージング方法
- システムのベースとして倒立顕微鏡ECLIPSE Ti2-Eを使用する場合は、Ti2-Eの項目に記載した観察方法も利用可能です。
- ビデオレートでの撮影
- ビデオレートは、通常、約30フレーム/秒(fps)と定義されていますが、 最適なイメージングレートは観察目的により異なります。一般的にEM-CCDカメラは最大60 fps(フルフレーム)で、sCMOSカメラは最大40〜100 fps(フルフレーム)で撮影可能です。
- 使用可能な顕微鏡
- それぞれのシステムを搭載可能な顕微鏡です。
- 相対的最大観察深度
- 十分な解像度とS/N比で画像取得できる、おおよその観察深度範囲(Z軸)を指します。この値は、サンプルや容器の光学特性や蛍光標識などにより大きく変動します。
- 視野数
- 対物レンズ倍率1倍における観察範囲の直径です。視野数が大きいほど標本の広い範囲を観察できます。