- ja Change Region
- Global Site
アプリケーションノート

高密度微小電極アレイチップ上の神経細胞の反射明視野観察が実現する、AIによる細胞領域予測
2023年12月
高密度微小電極アレイチップ(MaxOneおよびMaxTwo MultiwellHD-MEA、 MaxWell Biosystems)は、起電性細胞(網膜神経節細胞、心筋細胞、ヒトiPS細胞由来神経細胞、脳スライス、脳オルガノイドなど)の記録と刺激を同時に可能にする電気生理プラットフォームであり、神経科学研究や新薬の開発、および細胞の分析などに広く利用されている。一方で、これらのチップは不透明で光を透過しないため位相差顕微鏡法などの非染色ライブセル観察には適さず、培養状態の確認には細胞を固定して免疫染色や色素染色を行う必要がある。本アプリケーションノートでは、これらのチップにヒトiPS細胞由来神経細胞を播種して、正立顕微鏡 ECLIPSE LV100NDで画像を取得し、NIS-ElementsソフトウェアのAI技術を用いて解析することにより、チップ上の電極アレイに神経細胞が生着していることを確認できた事例を紹介する。
キーワード:MaxOne、MaxTwo、高密度微小電極アレイチップ、ヒトiPS細胞由来神経細胞、反射明視野観察、AI
Experiments
実験の概要
■細胞
- Quick-Neuron™ Excitatory-Human iPSC-derived Neurons (Healthy Control) (Elixirgen Scientific, EX-SeV-HC, Lot:QNGSVF-CW50065-20190131T-1M)
■試薬
- Poly-L-ornithine solution (Sigma-Aldrich, P4957-50ML)
- DMEM/F-12, no glutamine (Thermo Fisher Scientific, 21331-020)
- Neurobasal™ Medium (Thermo Fisher Scientific, 21103049)
- GlutaMAX™ Supplement (Thermo Fisher Scientific, 35050061)
- Penicillin-Streptomycin, Liquid (Thermo Fisher Scientific, 15140-122)
- Laminin Mouse Protein, Natural (Thermo Fisher Scientific, 23017015)
- Y-27632 2HCl (Selleck Chemicals, s1049)
- Quick-Neuron™ Excitatory -Maintenance Medium- (Elixirgen Scientific, EX-MM)
- Cellstain®- Calcein-AM solution (DOJINDO, C396)
- MaxOne HD-MEA Chips (MaxWell Biosystems AG)
■方法
MaxOneチップ(図1a)を30 μlのポリ-L-オルニチン溶液(0.002%)で2時間コートした後、100 μlのラミニン(20 μg/ml)で2時間コートした。さらに、Elixirgen Scientificのプロトコルに従い、神経細胞をチップあたり2x105細胞を播種し、37℃、5%CO2 環境下で培養した。2日毎に培地交換を行い、培養10日目の細胞をカルセインで染色しライブセル観察に用いた。
2.画像取得
MaxOneチップ上の神経細胞(図1a)について、正立顕微鏡LV100ND、TU Plan Fluor EPI 10X対物レンズ、浜松ホトニクスORCA-Flash4.0カメラ(16 bit)を用いて(図1b)、同一視野の反射明視野画像とカルセイン蛍光画像を、2枚のチップについて合計11セット取得した(図2a)。反射明視野画像はLED光源(EXCELITAS X-Cite Turbo)の525 nm照明光を用い、照明側開口絞りを絞って撮影した。カルセイン蛍光画像はLED光源の475 nm励起光とFITCフィルターキューブを組み合わせて撮影した。
図1. 反射明視野を用いたMaxOneチップ上の生細胞イメージング
(a) MaxOneチップ上の撮影領域
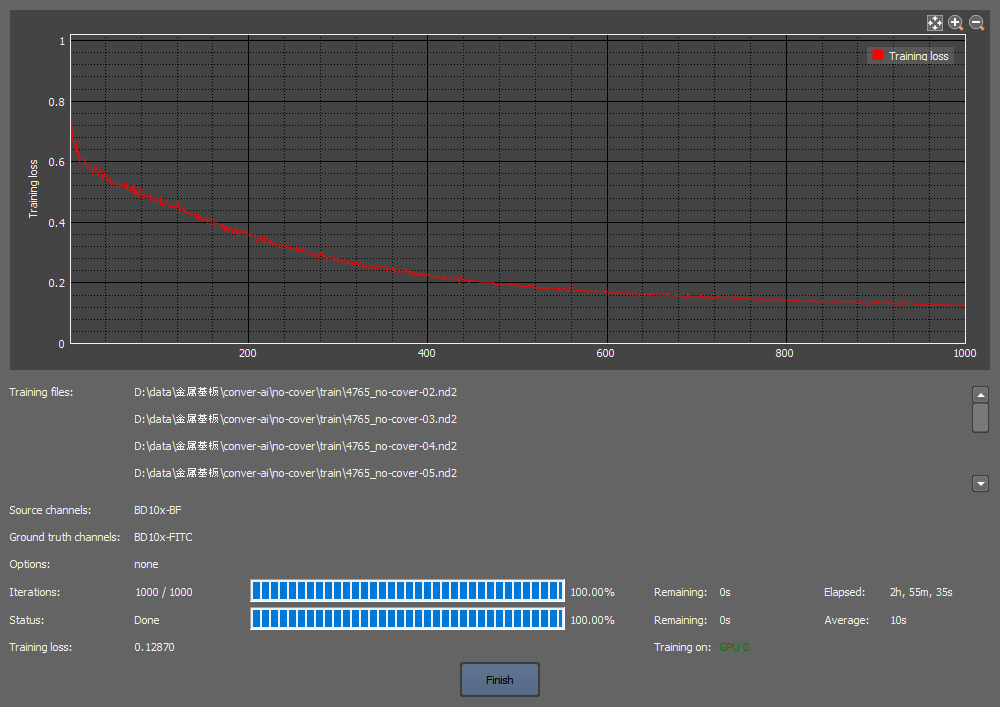
(b) 学習曲線
(c) 反射明視野画像
(d) AI予測画像
(e)カルセイン蛍光画像
図2. AI学習モデルによる細胞領域の推定
3.AI学習モデルによる細胞領域の予測
トレーニング用画像10セット(図2a)を使用し、NIS-Elements ARソフトウェアのConvert.ai機能により、反射明視野画像を元画像、カルセイン蛍光画像を正解画像として1000回学習させてAI学習モデルを作成した。学習曲線から、十分な学習が達成できたことが分かる(トレーニングロス0.129、図2b)。学習に使用しなかったテスト用反射明視野画像(図2c)を上記AI学習モデルに適用して細胞領域を予測し(図2d)、正解値と定義されるカルセイン蛍光画像(図2e)と比較したところ概ね一致していることを確認できた。画像解析をしたところ、カルセイン蛍光画像(図2e)の細胞は2067個で、そのうち73%がAIが予測した細胞と重なった。また、AI予測画像(図2d)の細胞は1886個で、そのうち80%がカルセイン蛍光画像の細胞と重なった。
まとめ
MaxOneチップのように、細胞培養容器の種類によっては、従来の透過光顕微鏡観察では生細胞を非染色では評価できないことがある。しかし、反射明視野観察とAI学習モデルを組み合わせることにより、試験前のチップ上の生細胞の播種密度の評価やばらつきの評価が可能になることで、試験結果の再現性や信頼性の向上に繋がる。この技術により、培養条件探索のための評価サンプル数を大幅に削減でき、実験効率の向上を図ることも可能である。
Product Information
正立顕微鏡 ECLIPSE LV100ND(反射/透過照明併用型)
透過照明による明視野・位相差・DIC・偏光観察のほか、高輝度ハロゲンランプ内蔵の反射照明装置を利用した明視野・蛍光・DIC・偏光観察にも対応します。
対物レンズ TU Plan Fluor EPI 10X
高NA(0.3)と長作動距離(17.5 mm)を両立した、 CFI60-2対物レンズ。反射観察に最適化されており、色収差補正に優れているため、鮮明でコントラストの高い画像が取得できます。
