- ja Change Region
- Global Site
アプリケーションノート
高感度共焦点顕微鏡ディテクターNSPARCを用いたオートファゴソームのライブイメージング
2024年11月
オートファジーは真核生物の主要な分解系であり、細胞の恒常性維持に必須である。その機能不全は癌や神経変性疾患等の発症及び進行に関与することが報告されている。オートファジーが誘導されると隔離膜と呼ばれる扁平膜構造が出現し、その後細胞質を隔離する二重膜小胞(オートファゴソーム)が形成され、最終的にリソソームと融合することで内容物の分解および栄養素の再利用が行われる。哺乳類のオートファジー誘導中には数十分程度で小胞体(ER)上に直径1 μmほどの二重膜小胞が多数形成されるが、その詳細な形成機構は明らかになっていない。
本アプリケーションノートでは、ダイナミックな膜変形を伴うオートファゴソームの形成過程を超解像共焦点レーザー顕微鏡システムAX with NSPARCを用いて観察した実例を紹介する。NSPARCでは、従来の共焦点顕微鏡観察と同様の手法で準備したサンプルについてより高い解像度、S/N比のデータ取得が可能になっている。また従来の共焦点顕微鏡よりも高速なライブイメージングを行うことにより、細胞へのダメージを抑えつつオートファゴソームの形成過程を3次元情報を含んだ形で可視化することができる。NSPARCを用いた観察により、閉じる直前のオートファゴソームの開口部の様子や隔離膜のZ軸方向への動きを捉えることができた。
キーワード:ライブイメージング、オートファゴソーム、隔離膜
研究の背景
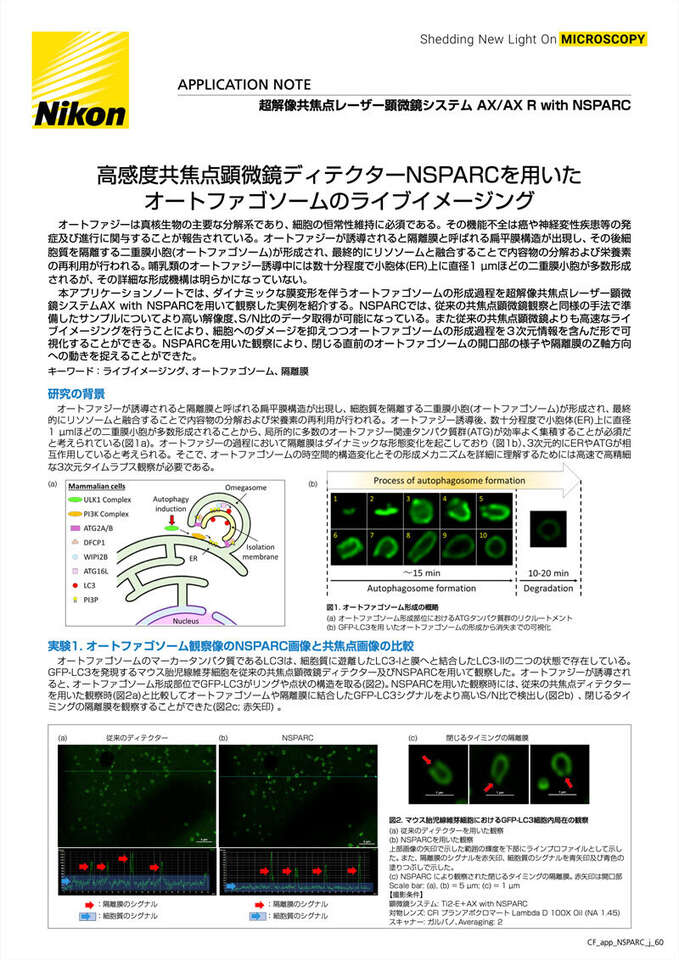
オートファジーが誘導されると隔離膜と呼ばれる扁平膜構造が出現し、細胞質を隔離する二重膜小胞(オートファゴソーム)が形成され、最終的にリソソームと融合することで内容物の分解および栄養素の再利用が行われる。オートファジー誘導後、数十分程度で小胞体(ER)上に直径1 μmほどの二重膜小胞が多数形成されることから、局所的に多数のオートファジー関連タンパク質群(ATG)が効率よく集積することが必須だと考えられている(図1a)。オートファジーの過程において隔離膜はダイナミックな形態変化を起こしており(図1b)、3次元的にERやATGが相互作用していると考えられる。そこで、オートファゴソームの時空間的構造変化とその形成メカニズムを詳細に理解するためには高速で高精細な3次元タイムラプス観察が必要である。
図1. オートファゴソーム形成の概略
(a) オートファゴソーム形成部位におけるATGタンパク質群のリクルートメント
(b) GFP-LC3を用いたオートファゴソームの形成から消失までの可視化
実験1. オートファゴソーム観察像のNSPARC画像と共焦点画像の比較
オートファゴソームのマーカータンパク質であるLC3は、細胞質に遊離したLC3-Iと膜へと結合したLC3-IIの二つの状態で存在している。GFP-LC3を発現するマウス胎児線維芽細胞を従来の共焦点顕微鏡ディテクター及びNSPARCを用いて観察した。オートファジーが誘導されると、オートファゴソーム形成部位でGFP-LC3がリングや点状の構造を取る(図2)。NSPARCを用いた観察時には、従来の共焦点ディテクターを用いた観察時(図2a)と比較してオートファゴソームや隔離膜に結合したGFP-LC3シグナルをより高いS/N比で検出し(図2b) 、閉じるタイミングの隔離膜を観察することができた(図2c; 赤矢印) 。
図2. マウス胎児線維芽細胞におけるGFP-LC3細胞内局在の観察
(a) 従来のディテクターを用いた観察
(b) NSPARCを用いた観察
上部画像の矢印で示した範囲の輝度を下部にラインプロファイルとして示した。
また、隔離膜のシグナルを赤矢印、細胞質のシグナルを青矢印及び青色の塗りつぶしで示した。
(c) NSPARC により観察された閉じるタイミングの隔離膜。赤矢印は開口部
Scale bar: (a), (b) = 5 µm; (c) = 1 µm
【撮影条件 】
顕微鏡システム: ECLIPSE Ti2-E+AX with NSPARC
対物レンズ: CFI プランアポクロマート Lambda D 100X Oil (NA 1.45)
スキャナー: ガルバノ、Averaging: 2
図3. オートファゴソーム形成の3次元ライブイメージング
GFP-LC3を発現するマウス胎児線維芽細胞をAX with NSPARCを用いて観察した。得られた蛍光画像について、Richardson-Lucy法によるデコンボリューションを行っている。
(a)基準となる撮影タイミングから9分後までの観察像を3次元表示した。矢印は単一のオートファゴソームを示している。4~8分の間で隔離膜が閉じていくダイナミックな変化をとらえることができた(黄色矢印)。 グリッド上の数値の単位はµm。
(b)オートファゴソームのZ軸方向への動きを捉えるために、取得した画像中の単一オートファゴソームについてXY平面画像を時間軸Z軸方向に並べた。隔離膜の形成が起きる200-450 秒のタイミングにおいてZ方向に大きく動いていることが明らかとなった。
【撮影条件 】
顕微鏡システム: ECLIPSE Ti2-E+AX with NSPARC
対物レンズ: CFI プランアポクロマート Lambda D 100X Oil (NA 1.45)
スキャナー: ガルバノ、Averaging: なし、Z-step: 0.15 µm、Z 取得範囲: 2 µm
実験2. NSPARCを用いたオートファゴソーム形成の3次元高速ライブイメージング
ダイナミックな形態変化を伴うオートファゴソーム形成過程を詳細に可視化するために、AX with NSPARCを用いて厚さ2 μmの範囲の3次元画像を取得しながら高速ライブイメージングを行った。Z軸方向について短い間隔で画像を多数取得するデコンボリューション処理に適した撮影条件でありながら、1Stackあたりのデータ取得にかかる時間が1.5秒程度と高速なデータ取得が実現され、10秒間隔で長時間撮影した際も蛍光の退色や細胞へのダメージが抑えられた。また取得画像のS/N比も高く、閉じる直前のオートファゴソームの開口部の様子を観察することができた(図3a)。さらにオートファゴソームの形成途中で隔離膜がXY方向だけでなくZ方向にも大きく動いていることが明らかとなった(図3b)。
まとめ
今回の観察によって、オートファゴソーム形成中に隔離膜が3次元空間においてダイナミックに動いていることが明らかとなった。関連するタンパク質の振る舞いを理解するためには、高S/Nで迅速なデータ取得を行う必要がある。オートファジー制御薬をスクリーニングする際に、指標となる蛍光シグナルを定量する方法が良く採用されている。S/N比を十分維持した上で高い時間分解能の観察が可能であるAX R with NSPARCを用いることにより、従来の共焦点顕微鏡を用いた観察よりも正確性の高いデータ取得が可能になると考えられる。また、データ取得の高速化によりレーザーによるサンプルへのダメージおよび蛍光の退色が抑えられた。今後は、従来の焦点顕微鏡では難しかったオートファゴソーム形成過程やオートファジー制御薬の影響の長時間にわたる観察を実現することが期待される。
謝辞
本アプリケーションノートの制作に関して全面的にご協力いただきました、北海道大学遺伝子制御研究所 野田展生先生および小笠原裕太先生に感謝いたします。
北海道大学遺伝子制御研究所 野田展生研究室HP:
https://mechanism.igm.hokudai....
製品情報
超解像共焦点レーザー顕微鏡システム AX/AX R with NSPARC
超解像ディテクターNSPARCは、25個のアレイディテクターにより、従来の共焦点レーザー顕微鏡システムAX/AX Rの機能を損なうことなく、さらなる高解像度を高S/N比で実現します。
