- ja Change Region
- Global Site
ナノイメージング
光学顕微鏡の解像度は数百年もの間、光の回折による制限を受け、約200 nmがXY解像度のおおよその限界と考えられてきました。これは、単一細胞や細胞レベル以下の構造を観察するには十分であるかもしれませんが、オルガネラ以下のサイズの微細構造や、ナノオーダーの生体一分子を観察するには十分であるとは言えません。
近年になり、この回折による限界を超えるためのさまざまな技術を活用した、「超解像」光学イメージング技術が数多く開発されています。超解像イメージングの重要性は2014年のノーベル化学賞においても認められ、軸索の周期的な足場構造など、すでにさまざまな発見に対して貢献しています。
ナノイメージングに関連する製品
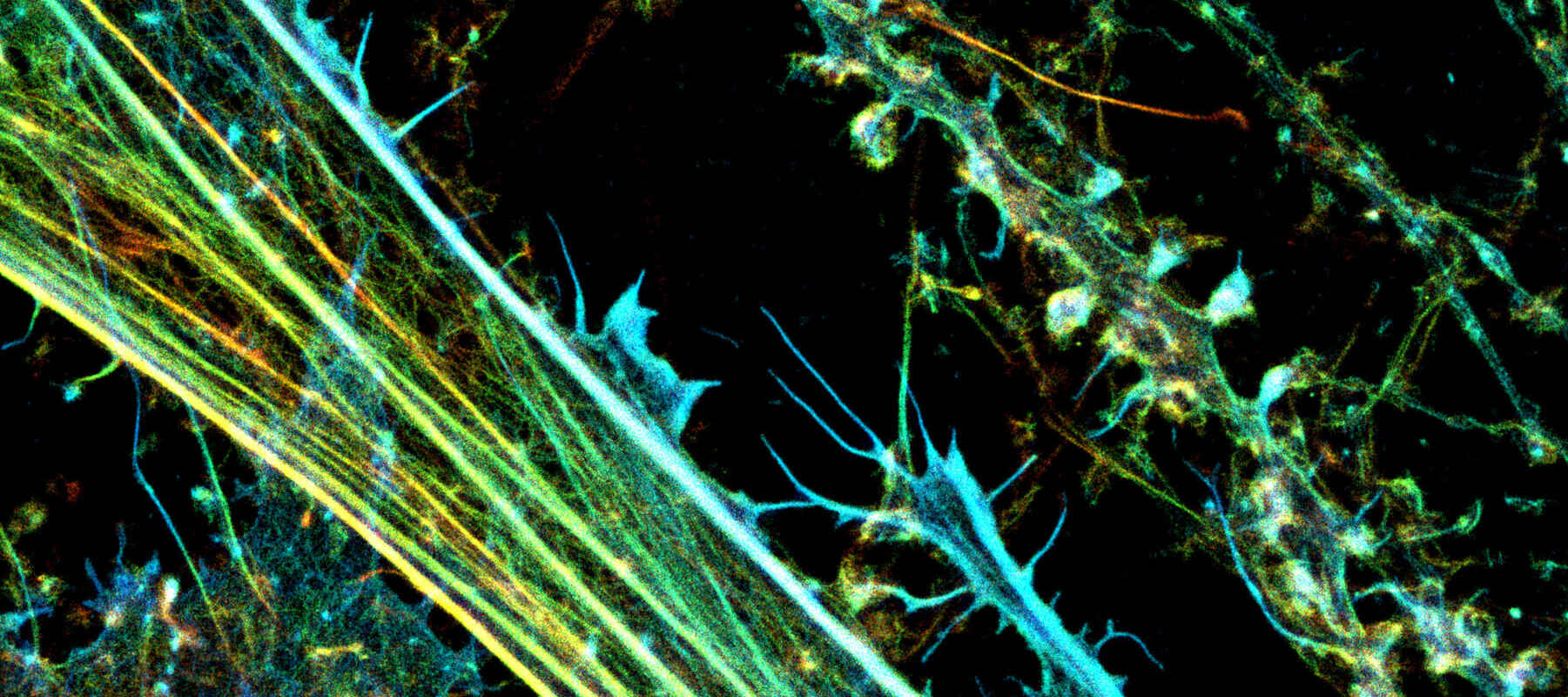
アクチンを蛍光標識した神経細胞培養の3D-STORM画像。(Z位置を色で表示)
撮影ご協力:Dr. Christophe Leterrier, CR1 CNRS
超解像顕微鏡N-STORMは、ニコンの顕微鏡システムの中で最も高い解像度を達成し、落射蛍光顕微鏡に比べてXYZ解像度を約10倍まで向上することが可能です。N-STORMを搭載するための倒立顕微鏡Ti2-Eは、自動焦点維持装置パーフェクトフォーカスシステム(PFS)により、高い安定性を提供します。これにより、ZスタックSTORMモードにおける、軸方向の微細な制御が可能になり、最大5 µmの厚さの画像が取得できます。N-STORMを使用して、従来の全反射照明蛍光(TIRF)イメージングを行うことも可能です。
超解像顕微鏡N-SIM Sは、パターンモジュレーション技術を採用した高速構造化照明システムにより、干渉縞パターンの高速切り換えを実現。9枚画像モード(2D-SIM、TIRF-SIM)や15枚画像モード(3D-SIM)での取得速度を向上します。2D-SIMは、最大15枚/秒(FPS)の高速取得が可能なため、生細胞イメージングに幅広く活用できます。TIRF-SIMは、TIRF顕微鏡の光学セクショニング機能に加えて、XY解像度をさらに向上できます。超解像顕微鏡N-SIM Eは、3D-SIMイメージングに対応するコストパフォーマンスに優れた機種で、N-SIM Sと同様の高い解像度を実現しています。
●:使用可能 , ⚬:オプション
| 超解像顕微鏡N-STORM | 超解像顕微鏡N-SIM S | 超解像顕微鏡N-SIM E | |
|---|---|---|---|
| 最大解像度 | ~20 nm (XY)* ~50 nm (Z)* |
~115 nm (XY)* ~86 nm (XY; TIRF-SIMモード)* ~269 nm (Z; 3D-SIMモード)* |
~115 nm (XY)* ~269 nm (Z; 3D-SIMモード)* |
| 最大観察深度 | ~ 5 μm | ~ 10 – 20 μm | ~ 10 – 20 μm |
| 画像取得速度 | ~0.1 FPS (一画像あたり最大500 Hzの取得速度) |
~15 FPS (2D-SIMおよびTIRF-SIM) |
~1 FPS (すべてのモード) |
| 対応波長数 | 3色 | 6色 | 3色 |
| 最大画像取得範囲 | 80 x 80 μm (100X対物レンズ使用時) |
66 x 66 μm (100X対物レンズ使用時) |
66 x 66 μm (100X対物レンズ使用時) |
| 使用可能な顕微鏡 | N-STORM | N-SIM S | N-SIM E |
| 倒立顕微鏡ECLIPSE Ti2-E | yes | yes | yes |
アプリケーションノート
ナノイメージングについて
用途に応じた超解像技術の選択
3D-SIMのZスタックによるスパインの定量解析、35ステップ、Z範囲:4.2 µm
露光時間:100 ms、120秒間隔
タイムラプス:11回
励起波長:488 nm
サンプル:GFPを発現したマウス海馬神経細胞の樹状突起スパイン
撮影ご協力:東京大学大学院医学系研究科 神経細胞生物学分野、柏木有太郎先生、岡部繁男先生
超解像イメージングは、回折限界を超えて解像度を向上させることができますが、それぞれの技術に独自の制限やトレードオフがあります。そのため、どの技術が最も研究に適しているかを判断する際には、それらを十分に理解することが必要です。
一番重要な点は、超解像画像の取得速度が、一般的には従来の観察方法よりも遅いことです。N-STORMでのイメージングは取得速度が比較的遅いため、1枚あたり1秒以上かかることが多く、生細胞イメージングには不向きです。また、STORMなどのSMLM技術は、解像度を最大限に向上させることはできますが、使用できる蛍光色素が限られるため、使用する蛍光色素から選択することが必要です。
N-SIM Sは、より高速(15 FPS)での取得が可能です。また、一般的な蛍光色素を使用でき、ライブセルイメージングにも適しています。
超解像イメージングのための高性能対物レンズ
倒立顕微鏡Ti2-Eに搭載したニコンの電動補正環対物レンズ。
他のイメージング技術と同様に超解像イメージングにおいても、光学分解能を最大にするためには、対物レンズの選択が最も重要となります
高い開口数を有する、さまざまな液浸に対応した対物レンズを用意しています。ニコンの超解像顕微鏡用対物レンズには、CFI SR HP アポクロマート TIRF 100XC Oil (油浸、NA 1.49)や、 CFI SR HP プランアポクロマート Lambda S 100XC Sil (シリコーン浸、NA 1.35)、CFI SR プランアポクロマート IR 60XC WI (水浸、NA 1.27)などがあります。これらの対物レンズは、それぞれの液浸において最高レベルのNAを実現しています。
超解像顕微鏡用対物レンズの中には、電動補正環が使用でき、球面収差補正の微調整を電動で行えるものがあります。これにより、最高レベルの解像度と三次元イメージングを実現します。
高解像度顕微鏡技術
蝸牛繊毛のポイントスキャン共焦点顕微鏡画像。高解像度機能適用前(左)と適用後(右)のXY画像とXZ画像
共焦点顕微鏡を用いても、高解像度イメージングが可能です。一般的な蛍光色素が使用でき、操作も簡単なため、超解像イメージングのような分解能を必要としない場合は、共焦点顕微鏡ベースの高解像度イメージングも選択肢となります。
「共焦点顕微鏡ベースの高解像度イメージングとは何か」を理解する上で鍵となるのは、従来の共焦点顕微鏡でも、一般的な落射蛍光顕微鏡よりも、解像度の向上が可能であり、ピンホールサイズの調整により、最高120 nm(XY)の分解能を達成できることです。
ポイントスキャン共焦点レーザー顕微鏡システムAX/AX Rは、高解像度の共焦点イメージングが可能です。可視域から近赤外域の蛍光色素を検出できることと、4波長までの同時取得が可能であることが特長です。ピンホールは六角形で、サイズが連続的に可変のため、より精度の高い調整が可能です。AX Rのレゾナントスキャナーを使用すれば、高解像度でありながら、ビデオレート(30 FPS)以上の高速でイメージングすることができます。
用語解説
- 使用可能な顕微鏡
- それぞれのシステムを搭載可能な顕微鏡です。
- 対応波長数
- 取得可能な波長の数を指します(蛍光色素ごとに1本のレーザー使用を想定)。
- 最大画像取得範囲
- 特定の対物レンズ倍率を使用して、その観察方法で取得できる最大視野。
- 最大観察深度
- 十分な解像度とS/N比で画像取得できる、おおよその観察深度範囲(Z軸)を指します。この値は、サンプルや容器の光学特性や蛍光標識などにより大きく変動します。
- 最大解像度
- 各システムの実際の解像限界。 水平方向(XY)解像度の値は、通常、軸方向(Z)解像度の値とは異なります。Z解像度の値の記載がない場合は、Z方向の解像度は通常の蛍光顕微鏡と同等です。
- 画像取得速度
- 速度はFPS(フレーム/秒)で表示します。