飯村忠浩先生
愛媛大学プロテオサイエンスセンター(PROS)バイオイメージング部門 部門長
愛媛大学学術支援センター(ADRES)病態機能解析部門 部門長
大学院医学系研究科 教授
関連製品
- N-SIM Super Resolution
- A1+ Confocal (現行機種:AX/AX R)
1. 先生の研究についてご紹介ください。
私は愛媛大学プロテオサイエンスセンター(PROS)バイオイメージング部門で、骨代謝を研究しています。分子生物学的手法やイメージングを用いて、高齢化社会の重要テーマである骨粗鬆症の発症メカニズムや治療薬の薬理効果を解析しています。また、学術支援センター(ADRES)病態機能解析部門では、本学医学部を中心に共通機器の管理や受託研究解析を技術職員の方々と担っています。
2. ニコン製品をどのようなアプリケーションに使用されていますか?
PROSバイオイメージング部門に設置されているのは超解像顕微鏡N-SIMです。
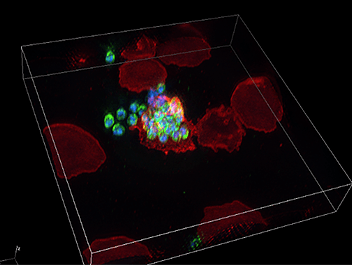
タンパク質科学の専門家が集まるPROSでは、新規タンパク質の細胞内ダイナミクスを、時間的・空間的に捉えるべくN-SIMを活用しています。PROSでは、研究室間の垣根が低く、お互いに得意な研究手法・知識を持ち寄って共同研究を進めるという文化が培われています。PROSマラリア研究部門(坪井敬文教授)との共同研究では、赤血球へのマラリア原虫の感染過程が、極めて美しい高分解能3次元画像として観察可能であることを見出しました(図1)。私はマラリア研究については専門外なのですが、画像の美しさとマラリア原虫という生命の巧妙さに、正直、心打たれています。両研究室の若手研究者やニコンのスタッフとの交流も含め、今後の共同研究の展開にワクワクしています。
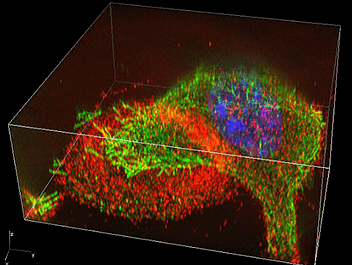
私自身は骨の細胞(骨芽細胞、破骨細胞、骨細胞)を研究していますが、N-SIMを使用して骨代謝研究に新しい視点を提供できると考えています。例えば、破骨細胞の骨との接着面には「アクチンリング」と呼ばれるアクチンの環状構造がありますが、この微小構成要素であるポドソームは電子顕微鏡でしか観察できませんでした。しかし、N-SIMでこのアクチンリングを観察すると、個々のポドソームが綺麗に分かれて観察できることに驚きました。超解像顕微鏡のなせる技です。電子顕微鏡の世界の観察対象の一部が、光学顕微鏡でも観察可能になってきました。N-SIMを使えば、ポドソームの構造や配列の変化がリアルタイムに観察できるので、微細構造の動的解析から破骨細胞の機能の変化を議論できるようになりました(図2)。
ADRESの病態機能解析部門には共焦点レーザー顕微鏡システムA1+を設置しており、性能はもちろんのこと、使い勝手もよく稼働率が非常に高い装置です。最近は画像統合ソフトウェアNIS-Elements C-ERを導入することで、N-SIMに近い分解能で微細構造を観察できるようになりました。さらに、タイリング処理で数百ミクロンの大きな破骨細胞の全体を画像取得できるため、広範囲の画像から観察ポイントを選んで拡大観察するマルチスケールの解析が可能です。検出器の能力も格段に向上しているので、撮像時間は短縮され、好みのコントラストを得るためのパラメータ設定も非常に簡単になりました。以前は条件設定に苦労する人もいましたが、今では誰もが使える装置になりました。超解像顕微鏡や多光子励起顕微鏡など、ハイスペックな顕微鏡が注目される中、共焦点レーザー顕微鏡の進化を感じさせるスペックで、とても好きですね。アジリティ(Agility)、ユーザビリティ(Usability), そしてコスパ(Cost Performance)の高い共焦点レーザー顕微鏡の進化は、今後も目が離せないと思います。
3. ニコンやその製品の優れている点はどこでしょうか?
製品の使いやすさですね。ソフトウェアを開くだけで、どのように操作するかが分かりやすくなっています。標準レベルからハイレベルな使い方まで階層構造となっているため、学術支援センターでもユーザーに説明しやすいです。
さまざまな観察対象に対して、対物レンズをはじめ、多彩な製品ソリューションを提案してくれることも素晴らしいと思います。骨組織の観察では、微細な年輪構造や小孔を観察することで病態や恒常性を調べます。ニコンの微分干渉顕微鏡は非常に微細な部分まで観察でき、その美しさに感動しました。微分干渉の分解能とコントラストはトレードオフの関係なので、その落とし込み方の「巧さ」は、本当に素晴らしいと思いました。まさに、ニコンの「匠」の技術を感じましたね。こういったニコンの技術の高さと幅広さ、そして親切なサポートがうれしいですね。スタッフと良いコミュニケーションがとれるので、使っていて顕微鏡への理解と愛着が深まります。
4. 将来の顕微鏡に求めるものは何でしょうか?
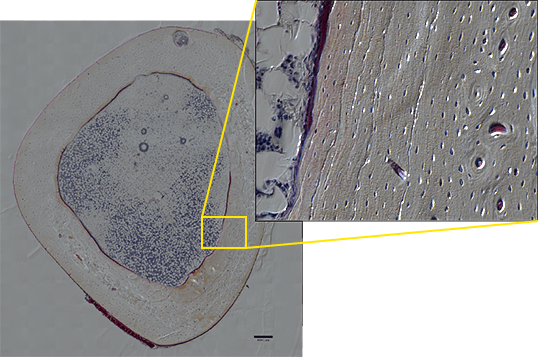
やはり今後はマルチスケールな使い方が重要になると思います。例えば、骨切片全体をタイリングで取得した微分干渉画像では、骨の全体像をマウスクリックでズームアップしていくと、骨の層状構造や年輪構造、さらには骨細胞ネットワークも確認できるため、観察した現象をより高い説得力を持って提示できます(図3)。将来的には、同一サンプルの同一箇所の臓器・組織・分子レベルまでを観察できるのが理想です。これを実現するためのシームレスな観察が可能な顕微鏡を求めています。
5. 顕微鏡の将来的なアプリケーションについてお聞かせください。
超解像顕微鏡で観察していると、従来の生化学実験では互いに結合すると理解されてきたナノサイズのタンパク質が、生体内ではダイナミックに結合と解離を繰り返していることがよくわかります。生体内の分子の動きは揺らいでおり、さらにそれが細胞の機能のバラつきや、組織全体に重要な影響を与えるのです。分子の揺らぎをより詳細に数値化することで、生体情報や病態情報をより正確に把握することが、今後ますます顕微鏡に求められると思います。揺らぎやノイズの中での整合性が、生命らしさの本質です。生命の本質に、新たな視点を与えるという顕微鏡の使命は、今後も発展的に続くと思います。
