- ja Change Region
- Global Site
アプリケーションノート
idenTx プラットフォームを利用したin vitro BBBモデルの共焦点イメージング
2023年4月
血液脳関門(Blood-brain barrier、以下BBB) のin vitroモデルは、神経に作用する薬剤を開発する際の前臨床研究において薬物送達の有効性を評価するのに重要であり、また様々な疾患における神経血管機能の病的異常を理解する際にも重要である。本アプリケーションノートでは、AIM Biotech社の3D細胞培養チップを用いて、ロバスト性と費用対効果の高いin vitro BBBモデルを構築した事例を紹介する。ヒト脳血管内皮細胞(EC)、ヒトペリサイト(PC)、ヒトアストロサイト(AC)を共培養することにより、フィブリンゲル内において自己組織的に微小血管ネットワークを構築した。次に、このBBBモデルについて細胞種特異的マーカーとBBB特異的マーカーで染色し、ニコンの共焦点顕微鏡を使用することによって、生理学的に適切な3次元BBBモデルの構造を確認できた。また、このBBBモデルの透過性を画像解析によって計測し、ラット脳におけるin vivoの計測値と同等であることを確認した。
実験の概要
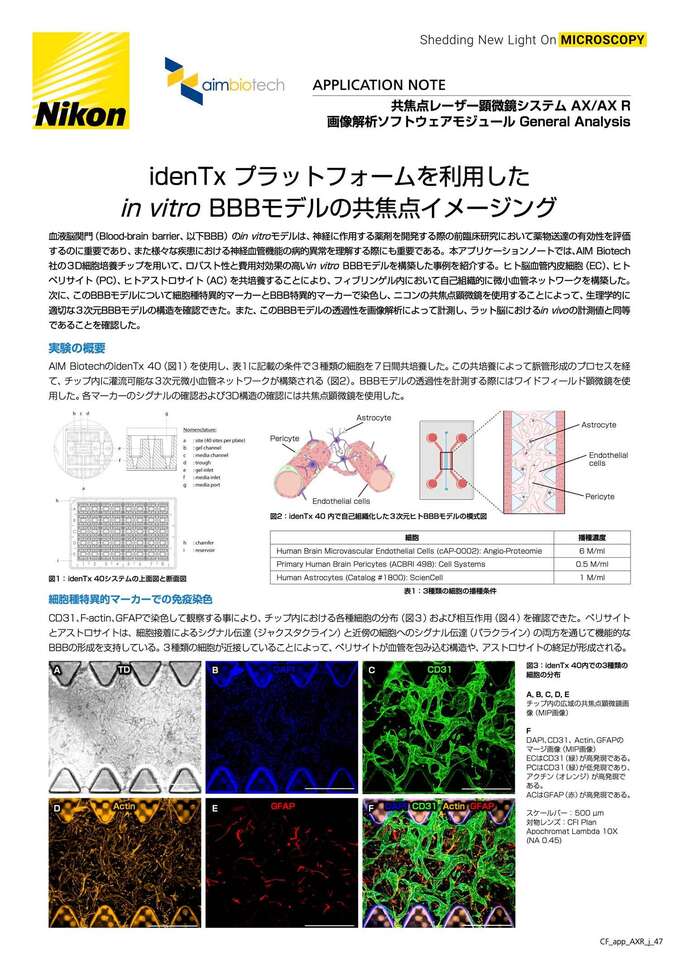
図1: idenTx 40システムの上面図と断面図
AIM BiotechのidenTx 40(図1)を使用し、表1に記載の条件で3種類の細胞を7日間共培養した。この共培養によって脈管形成のプロセスを経て、チップ内に灌流可能な3次元微小血管ネットワークが構築される(図2)。BBBモデルの透過性を計測する際にはワイドフィールド顕微鏡を使用した。各マーカーのシグナルの確認および3D構造の確認には共焦点顕微鏡を使用した。
図2:idenTx 40 内で自己組織化した3次元ヒトBBBモデルの模式図
| 細胞 | 播種濃度 |
|---|---|
| Human Brain Microvascular Endothelial Cells (cAP-0002): Angio-Proteomie | 6 M/ml |
| Primary Human Brain Pericytes (ACBRI 498): Cell Systems | 0.5 M/ml |
| Human Astrocytes (Catalog #1800): ScienCell | 1 M/ml |
細胞種特異的マーカーでの免疫染色
CD31、F-actin、GFAPで染色して観察する事により、チップ内における各種細胞の分布(図3)および相互作用(図4)を確認できた。ペリサイトとアストロサイトは、細胞接着によるシグナル伝達(ジャクスタクライン)と近傍の細胞へのシグナル伝達(パラクライン)の両方を通じて機能的な BBBの形成を支持している。3種類の細胞が近接していることによって、ペリサイトが血管を包み込む構造や、アストロサイトの終足が形成される。
図3:idenTx 40内での3種類の細胞の分布
A, B, C, D, E
チップ内の広域の共焦点顕微鏡画像(MIP画像)
F
DAPI、CD31、Actin、GFAPの マージ画像(MIP画像)
ECはCD31(緑)が高発現である。 PCはCD31(緑)が低発現であり、アクチン(オレンジ)が高発現である。
ACはGFAP(赤)が高発現である。
スケールバー: 500 µm
対物レンズ:CFI Plan Apochromat Lambda 10X (NA 0.45)
図4:idenTx 40内での3種類の細胞の相互作用
A, B ,C
微小血管ネットワークの3次元画像
Aの画像から血管、ペリサイト、アストロサイト間で複雑な相互作用が確認できる。
Bはペリサイトが微小血管を包み込んでいる領域の拡大画像。Cはアストロサイトが微小血管と相互作用している領域の拡大画像。
D
微小血管の断層像
血管内皮細胞のチューブ構造がペリサイトによって包み込まれている(白矢印)。スケールバー: 100 µm
対物レンズ:CFI Apochromat LWD Lambda S 20XC WI (NA 0.95)
BBB特異的マーカーでの免疫染色
idenTxプラットフォームを用いて作成した3次元BBBモデルが、CLAUDIN-5やZO-1といったBBBに特異的なタイトジャンクションを構成するタンパク質も発現していることは、健康な状態であることを示唆している。また、ラミニンのような基底膜を構成するタンパク質が血管ネットワーク全体に発現していることも、機能的なBBBが形成されていることを示唆している。
図5:BBB特異的マーカーの発現
A, B, C, D:チップ内の広域の共焦点顕微鏡画像(MIP画像)、スケールバー: 500 µm
a, b, c, d:A, B, C, Dの拡大画像、スケールバー: 100 µm、
対物レンズ: CFI Plan Apochromat Lambda 10X (NA 0.45)
BBB透過性の定量評価
微小血管の透過性を定量評価するために、分子量 70 kDaのFITC-dextranをidenTxプラットフォーム内の微小血管に灌流させた。次に、70 kDa FITC-dextranのBBB透過性を算出するためにタイムラプス観察を行い、血管周辺のフィブリンゲル領域における蛍光輝度値の時間変化を計測した。(定量評価のステップについての詳細はAIM Biotech社ウェブサイトのBBBプロトコールをご参照ください。)
図6:蛍光画像を用いたBBB透過性の評価
A:70 kDa FITC-dextranを灌流させた微小血管の各時間における蛍光画像
B:血管と周辺領域を区別するためにZスタック画像を重ね合わせ(上図)、二値化処理を実施(下図)した。
血管周辺のフィブリンゲルを抽出した領域(白いマスク)において、70 kDa FITC-dextran灌流後3分後と15分後の平均輝度値を比較したところ、時間変化とともに増大した。
C:70 kDa の分子量について今回得られた10-7 (cm/s)という透過係数の数値範囲は、ラット脳のin vivo 実験から得られた数値と類似している。
血管構造の定量評価
微小血管構造について数値評価することは、血管の透過性評価実験を正確に実施する際や、適切な培養条件を検討する際に重要となる。NIS-ElementsソフトウェアのGeneral Analysis(GA)機能を使用すると、2次元画像に対しては血管の直径、円形度、分岐数などを計測することが可能である。さらに、3次元画像に対しては共焦点顕微鏡のZスタック画像から血管構造やメディアチャネル領域のバイナリーマスクを作成し、体積や表面積を計測することが可能となる(図7)。
図7:共焦点顕微鏡のZスタック画像から3次元構造を検出
A:細胞特異的マーカーで染色したサンプルの3次元画像、B:CD31についての3次元画像、C:血管の3次元バイナリーマスク(黄)と培地チャンネル領域の3次元バイナリーマスク(青)、対物レンズ: CFI Plan Apochromat Lambda 10X (NA 0.45)
製品情報
idenTx 40 Plate (AIM Biotech)
プレート寸法はSBS規格に準拠しており、1 枚のプレートで同時に 40 条件の実験を実施することが可能です。idenTx 40プレートを使用することにより、既存の分析機器とシームレスに連携させながら、生体内の微小環境を正確に再現する必要のある創薬アッセイにおいて、スループットを向上させることができます。
AX/AX Rは、従来機比4倍の8Kx8K画素の高解像度画像を実現。対角25mmの広視野でサンプルの広範囲を一度に撮影でき、光毒性を低減します。AX Rのレゾナントスキャナーは、2Kx2Kの高解像度を実現。毎秒720フレーム(2048 x 16画素)の高速取得により、生きたサンプルの変化や反応を逃さず捉えます。
