- ja Change Region
- Global Site
アプリケーションノート
NSPARC を用いた核酸医薬の細胞内デリバリー画像解析
19塩基(約10nm)の短いDNAの局在解析
2024年9月
核酸医薬は、十数~数十塩基のDNA や RNA またはその誘導体で構成された核酸分子であり、目的遺伝子の発現を制御できる新たな医薬品カテゴリーである。この核酸医薬開発工程で大きな鍵となっているのは、核酸が標的細胞まで運ばれ、細胞内に入り、細胞内で直ちに分解されることなく機能するデリバリー技術の開発である。
東京大学工学系研究科 岡本晃充教授の研究室に所属する核酸化学研究グループの森廣邦彦准教授と高津正子研究員*1は、約 20 塩基の短い核酸分子(約 10 nm)に直接化学修飾をすることにより、核酸分子に細胞内送達性および安定性を付与する研究を進めており、用途に応じて最適な化学構造の分子設計を行う際に、細胞内の核酸分子イメージングと画像解析を活用している。
本アプリケーションノートでは、超解像共焦点レーザー顕微鏡システム AX R with NSPARC で撮影したことにより初めて明らかになった、フッ素官能基修飾核酸の化学構造の違いがもたらす細胞内取り込みへの影響を報告した実験を紹介する〈東京大学フッ素有機化学研究室 相川光介先生*2、 AGC株式会社 岡添隆先生との共同研究〉 。
キーワード:核酸医薬・ドラッグデリバリー・フッ素・化学修飾核酸・医薬品の画像解析スクリーニング
現所属
*1 東京大学総合文化研究科広域科学専攻
*2 日本大学医学部医系自然科学分野
研究の概要
核酸を利用した治療は、対象遺伝子配列に応じて塩基配列を変更することにより、広範囲の標的に対して高い特異性を持ち迅速に開発することができる。新型コロナウイルスに対するmRNAワクチンでは4,000 塩基対以上の長さの mRNA を50-100 nmの Lipid Nano particle (LNP) に包んで処方している。一方、核酸医薬は20 塩基前後の短いDNA/RNA のみで構成され、核酸に直接化学修飾することで効率よく細胞内に導入することができる。 化学修飾による細胞内送達は、サイズが小さいため細胞へのダメージが少なく、化学構造が規定されるので製造と品質管理が容易、さらに核酸分子以外の成分を含まないため副作用が少ない方法といわれている。
本実験では、フッ素官能基を修飾した DNA の細胞導入様式と細胞導入効率を詳細に調べた(図 1)。蛍光修飾した約 10 nmの化学修飾核酸のイメージングでは、解像度と視野の制約により系統的解析を行うことが難しかったが、超解像共焦点レーザー顕微鏡システム AX R with NSPARC が持つ高解像度・高S/N 比と視野の広さ・撮影スピードを活用することにより、細胞取り込み様式に加え、特定の条件下における核酸の凝集や分散の集団的傾向の違いを捉えることができた。
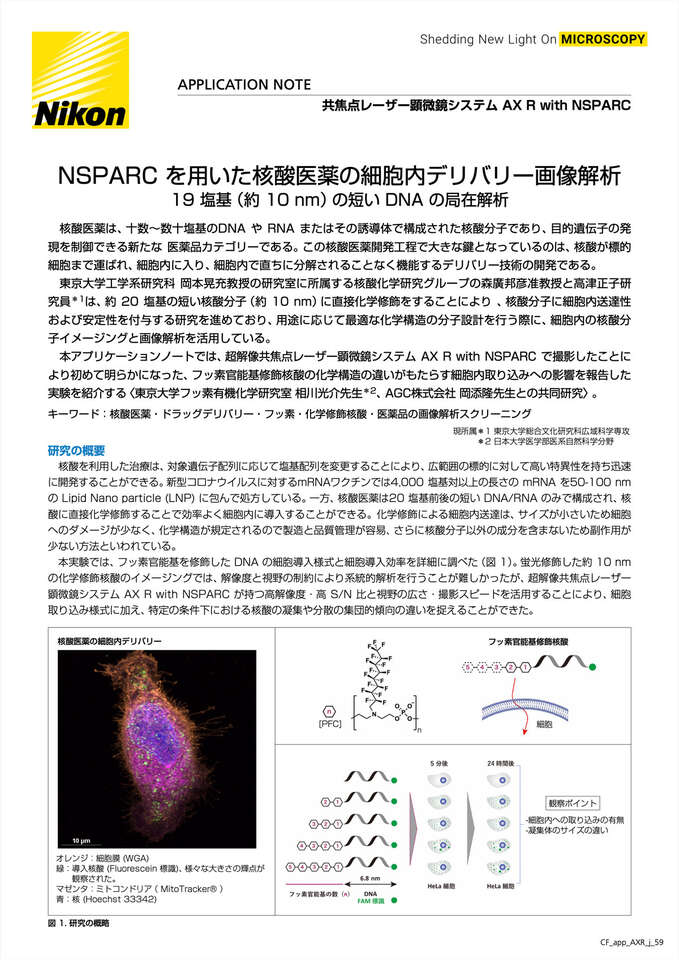
核酸医薬の細胞内デリバリー
オレンジ:細胞膜 (WGA)
緑:導入核酸 (Fluorescein 標識)、様々な大きさの輝点が観察 された。
マゼンタ:ミトコンドリア( MitoTracker® )
青:核 (Hoechst 33342)
図 2 HeLa 細胞内に導入された化学修飾核酸の観察
(A) 化学修飾核酸(フッ素官能基数 n = 2 または 4 )を細胞導入後、24 時間後の細胞の A1 共焦点顕微鏡あるいは NSPARC による観察像。それぞれ右側の図は左側の図の白枠部の拡大図。 NSPARC による観察像で捉えられた、n = 2 には見られない大きいサイズの凝集体を赤矢印で示した。
(B)化学修飾核酸(フッ素官能基数 n = 0 ~ 5)を細胞導入後、 5 分後及び 24 時間後の細胞の NSPARCによる観察像。Z 軸方向に約 10 µm の範囲について 0.15 µm 間隔で取得した画像の MIP 像。それぞれ右側の図は左側の図の白枠部の拡大図。
白:細胞膜 (WGA) 左側の図のみ
緑:導入核酸 (Fluorescein 標識)
青:核 (Hoechst 33342)
Scale bar: 10 µm
【撮影条件 】
NSPARC
顕微鏡システム:Ti2-E+AX R with NSPARC
対物レンズ:CFI プランアポクロマート Lambda D100X Oil (NA 1.45)
スキャナー:ガルバノ、Averaging:なし
A1
顕微鏡システム:Ti-E+A1
対物レンズ:CFI プランアポクロマート VC 60X Oil (NA 1.4)
スキャナー:ガルバノ、Averaging:8 回
Adapted with permission from M. Takatsu, K. Morihiro, H. Watanabe, M. Yuki, T. Hattori, K. Noi, K. Aikawa, K. Noguchi, M. Yohda, T. Okazoe, and A. Okamoto, Cellular penetration and intracellular dynamics of perfluorocarbon-conjugated DNA/RNA as a potential means of conditional nucleic acid delivery, ACS Chem. Biol. 18(12), Nov 19, 2023, 2590-2598. https://doi.org/10.1021/acschembio.3c00612. Copyright 2023 American Chemical Society
実験と結果
フッ素官能基数 n を変えた化学修飾核酸([PFC]n-DNA)を、それぞれ蛍光標識し細胞内に導入した。超解像共焦点レーザー顕微鏡システム AX R with NSPARC 及び A1 共焦点顕微鏡を用いて観察したところ(図 2)、従来のA1共焦点顕微鏡では凝集状態の差を識別できなかったが、 AX R with NSPARC を用いた観察では単分散の凝集体(n = 2)と多分散の凝集体(n = 4)を見分けることができた(図 2A)。導入 5 分後において[PFC]2-DNA は単分子、[PFC]3,5-DNA は単分散の凝集体、[PFC]4-DNA は多分散の凝集体を形成し細胞膜と相互作用していることが明らかとなった。24 時間後の細胞質内では、[PFC]3-DNA は細胞導入初期の凝集状態を保つが [PFC]5-DNA は多分散の凝集状態へと変化した(図 2B)。同様に高い解像度をもつ構造化照明顕微鏡法を用いた超解像顕微鏡と比較して、撮影時間が約1/10、視野は3.8倍であるため、全体の傾向を限られた時間内で撮影することができた。上記の実験結果から、フッ素官能基数が最小で細胞内に効率的に取り込まれるのは[PFC]2を付与した核酸であることが明らかとなったため、 [PFC]2を付与したsiRNAを細胞内に導入したところ、遺伝子抑制効果が確認された(参考文献参照)。
まとめと今後の展望
約10 nmの短い化学修飾核酸の細胞内送達性および細胞内安定性をAX R with NSPARCを用いて高解像度・高S/N比で可視化し、化学構造のわずかな違いがもたらす核酸分子の凝集と分散状態の傾向と細胞内取り込みの相関を解析することができた。今後はこれらの画像情報を基に、核酸分子の細胞内における形態変化が核酸医薬品としての機能にどのように影響するかを解析する予定である。本研究の解析により、画像解析を活用して、核酸デリバリーのための化学修飾を目的に応じて選択できる実用的なプラットフォーム構築へ一つ前進した。このプラットフォームが実現されれば、核酸医薬の潜在的可能性として言及されている、さまざまな疾病や基礎疾患、感染症への創薬ターゲット拡大が期待される。
謝辞
本アプリケーションノートの制作に関して全面的にご協力いただきました、東京大学工学系研究科岡本晃充教授、
森廣邦彦准教授、高津正子研究員に感謝いたします。
東京大学 工学系研究科 岡本晃充研究室HP: https://webpark1516.sakura.ne.jp/
参考文献
M. Takatsu, K. Morihiro, H. Watanabe, M. Yuki, T. Hattori, K. Noi, K. Aikawa, K. Noguchi, M. Yohda, T. Okazoe, and A. Okamoto, Cellular penetration and intracellular dynamics of perfluorocarbon-conjugated DNA/RNA as a potential means of conditional nucleic acid delivery, ACS Chem. Biol. 18(12), Nov 19, 2023, 2590-2598.
製品情報
超解像共焦点レーザー顕微鏡システム AX/AX R with NSPARC
超解像ディテクターNSPARCは、25個のアレイディテクターにより、従来の共焦点レーザー顕微鏡システムAX/AX Rの機能を損なうことなく、さらなる高解像度を高S/N比で実現します。
