- it Change Region
- Global Site
- Casa
- Applicazioni
- Scienze della vita
- Imaging cellulare dal vivo
Imaging cellulare dal vivo
È difficile sottovalutare nell’ambito della moderna biologia cellular, l'importanza della microscopia di cellule vive en in particolare dell'imaging a fluorescenza,. L'imaging a fluorescenza delle cellule vive consente di osservare la dinamica e le interazioni di specifiche biomolecole per lunghi periodi di tempo. Negli ultimi decenni, numerose innovazioni tecnologiche hanno contribuito a rendere utile l'imaging dal vivo, compreso lo sviluppo di proteine fluorescent espresso geneticamente e di marcatori specifici. L'imaging delle cellule vive viene in genere eseguito utilizzando un microscopio invertito per adattarsi meglio ai mezzi di cultura pieni di medi o di recipienti da imaging.
Prodotti per l'imaging di cellule vive
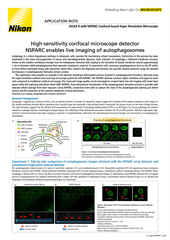
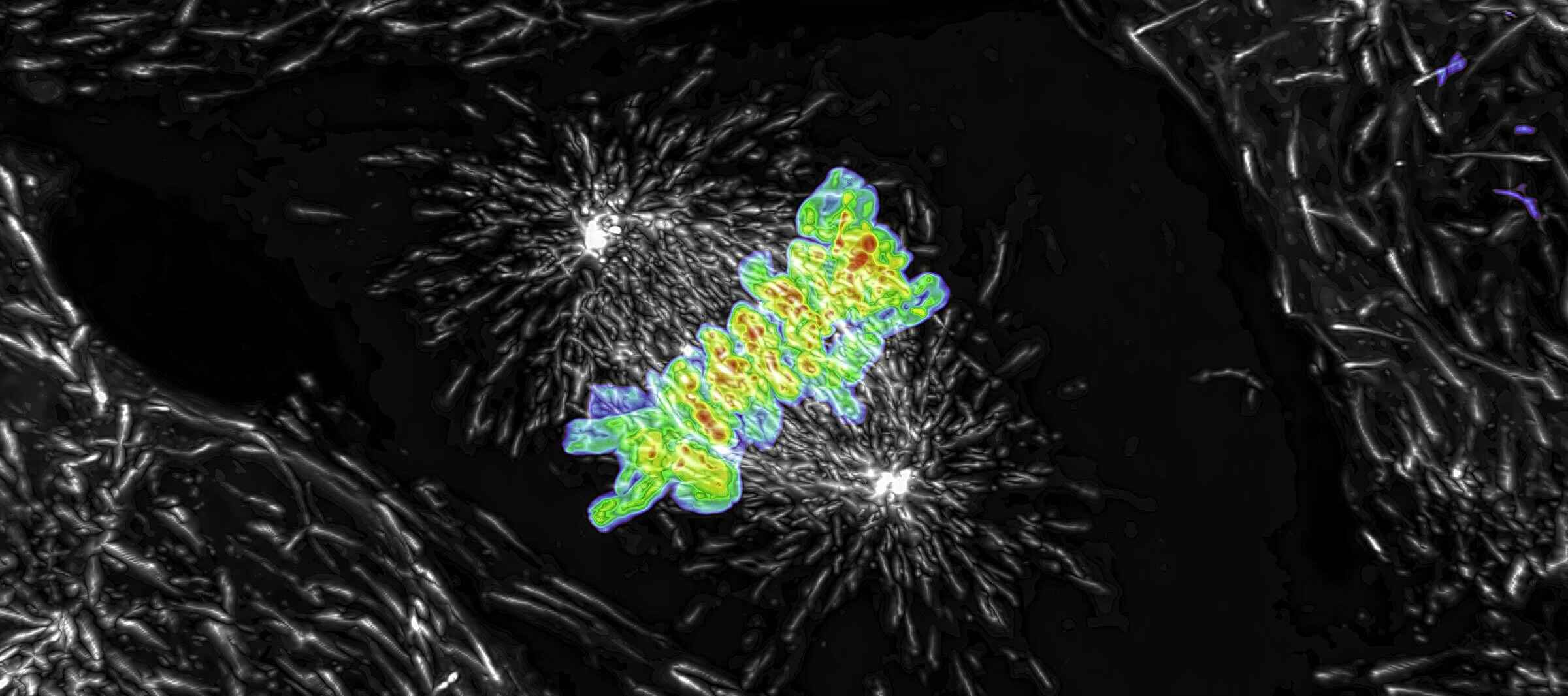
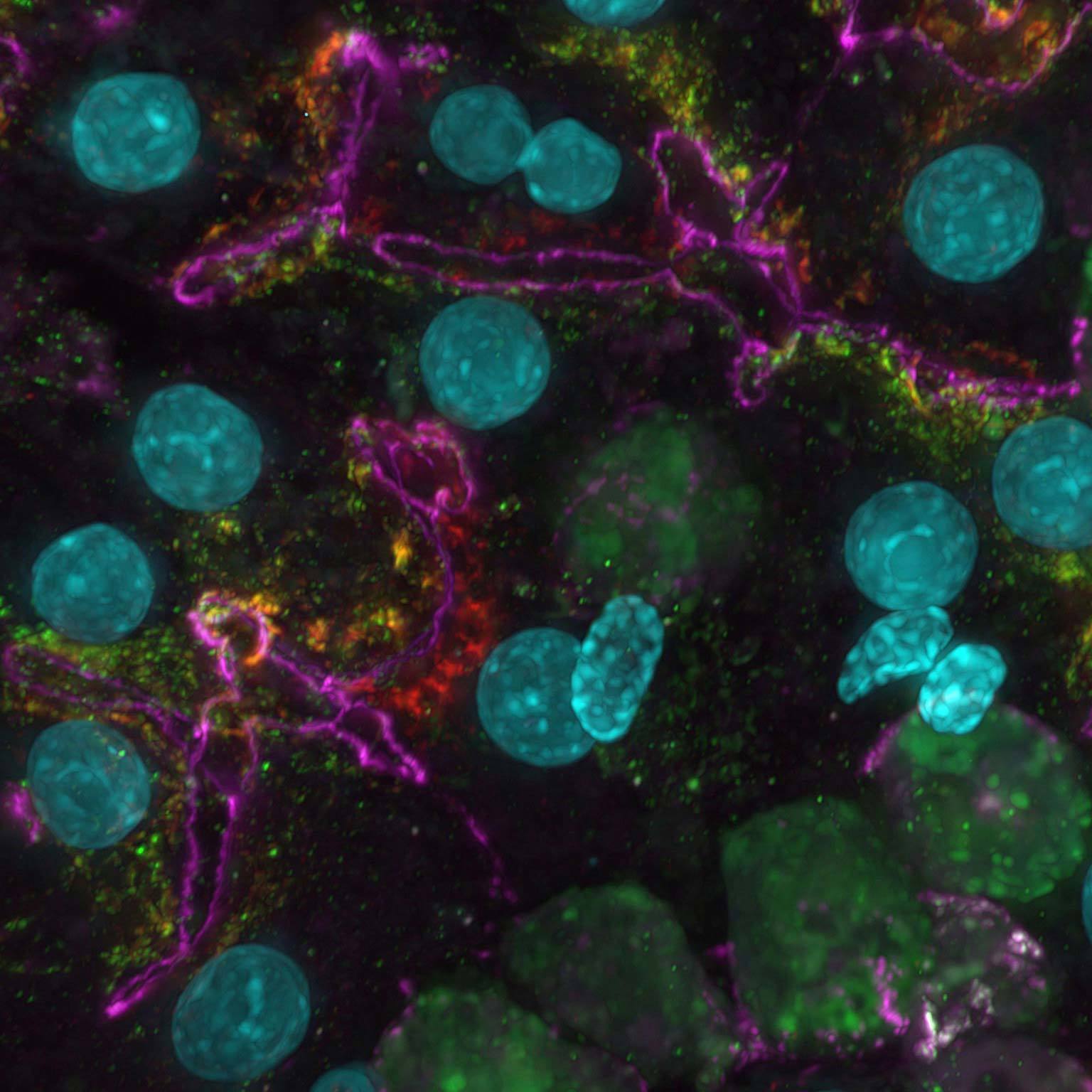
Proiezione di intensità massima di uno Z- stack raccolto di una cellula mitotica viva, acquisita utilizzando lo scanner risonante AX R operante a 15 FPS e una risoluzione in pixel di 2048 x 1024. L'obiettivo era un CFI Plan Apo Lambda 60X Oil, 1,4 NA
Il microscopio invertito motorizzato ECLIPSE Ti2-E è il supporto per microscopio consigliato per l'imaging di cellule vive: può essere combinato con tutte le opzioni confocali e a super-risoluzione qui descritte. Perfect Focus System 4 (PFS4) è la tecnologia di blocco della messa a fuoco basata su hardware leader del settore, che consente l'imaging di cellule vive a lungo termine senza deriva focale e compatibile con recipienti di coltura in vetro e plastica. È inoltre disponibile un erogatore d'acqua automatico per obiettivi ad immersione in acqua.
Il sistema di illuminazione modulare Ti2-LAPP consente di combinare un singolo microscopio con un massimo di cinque diversi moduli di illuminazione, con opzioni disponibili per TIRF, epifluorescenza ad ampio campo e fotostimolazione, inclusi dispositivi FRAP e dispositivi a microspecchi digitali (DMD). È possibile configurare più moduli di illuminazione TIRF su un unico supporto, consentendo immagini multicanale simultanee con l'angolo TIRF ottimale per ciascuna linea laser.
I microscopi confocali AX / AX R sono le soluzioni confocali a scansione puntiforme di Nikon, con l'AX R dotato di un sistema di scansione risonante veloce che supporta l'imaging con velocità video di 30 fotogrammi al secondo (FPS) a 512 x 512 pixel. Ciò è ulteriormente supportato dal modulo software Denoise.ai, che rimuove automaticamente il rumore dello scatto, la principale fonte di rumore nelle immagini confocali a scansione risonante.
I sistemi confocali a disco rotante della serie Yokogawa CSU sono soluzioni popolari per l'imaging di cellule vive. Il CSU-W1 è migliore per l'imaging di sistemi modello più spessi, come gli organoidi, grazie alla più ampia spaziatura tra i pinhole, che riduce la diafonia del segnale tra i fori di spillo adiacenti, consentendo un'imaging più profondo nei campioni di dispersione.
La microscopia a super risoluzione continua a diventare più raffinata e pratica per le applicazioni di imaging di cellule vive. Sono disponibili le modalità 2D-SIM, 3D-SIM e TIRF-SIM. Yokogawa CSU-W1 SoRa è uno strumento confocale a disco rotante che integra un disco con microlenti a emissione per realizzare una super risoluzione mediante la riassegnazione dei pixel ottici.
●: included, ⚬: option
| ECLIPSE Ti2-E Microscopio invertito (imaging a campo ampio)* |
AX R Sistema confocale risonante |
CSU-X1 Scanner confocale a disco rotante |
CSU-W1 Scanner confocale a disco rotante |
Ti2-LAPP E-TIRF Illuminatore |
N-SIM S Sistema a super risoluzione |
CSU-W1 SoRa Sistema a super risoluzione del disco rotante |
|
|---|---|---|---|---|---|---|---|
| Limite di profondità di imaging relativo | ~ 5 μm ~ 15 – 25 μm (con deconvoluzione) |
~ 100 – 500 μm | ~ 50 μm | ~ 50 – 100 μm | ~ 100 – 300 nm | ~ 10 – 20 μm | ~ 50 – 100 μm |
| Supporta l’imaging video-rate | Sì |
Sì (30 FPS con scansione 512 x 512) | Sì |
Sì (limitato dal sistema della fotocamera e dalla velocità di rotazione del disco) |
Sì (limitato dal sistema di telecamere) |
No (solo 15 FPS con 2D-SIM e TIRF-SIM) | Sì (limitato dal sistema della fotocamera e dalla velocità di rotazione del disco) |
| Campo visivo | Diagonale 25 mm (circolare) | Diagonale 25 mm (quadrato) | 10 x 7 mm (rettangolare) | 17 x 16 mm (rettangolare) | ~ 10 mm di diagonale (circolare) | ~ 9.3 mm di diagonale (circolare) | 17 x 16 mm (rettangolare) |
| Modalità di imaging supportate | ECLIPSE Ti2-E | AX R | CSU-X1 | CSU-W1 | Ti2-LAPP E-TIRF | N-SIM S | CSU-W1 SoRa |
| Campo luminoso | yes | no | no | no | no | no | no |
| Confocale - Scansione puntiforme | no | yes | no | no | no | no | no |
| Confocale - Disco rotante | no | no | yes | yes | no | no | yes |
| Campo scuro | yes | no | no | no | no | no | no |
| Contrasto di interferenza differenziale (DIC) | yes | no | no | no | no | no | no |
| Contrasto a modulazione avanzata Nikon (NAMC) | yes | no | no | no | no | no | no |
| Contrasto di fase | yes | no | no | no | no | no | no |
| Super risoluzione - Illuminazione strutturata | no | no | no | no | no | 2D-SIM, TIRF-SIM, 3D-SIM | |
| Super-Risoluzione - Microscopia di riassegnazione dei pixel ottici | no | no | no | no | no | no | yes |
| Fluorescenza a riflessione interna totale (TIRF) | no | no | no | no | yes | no | no |
| Contrasto di volume | yes | no | no | no | no | no | no |
| Fluorescenza ad ampio campo | yes | no | no | no | no | no | no |
| Supporti per microscopio compatibili | ECLIPSE Ti2-E | AX R | CSU-X1 | CSU-W1 | Ti2-LAPP E-TIRF | N-SIM S | CSU-W1 SoRa |
| ECLIPSE Ti2-E invertito | no | yes | yes | yes | yes | yes | yes |
| ECLIPSE Ti2-A invertito | no | no | yes | yes | no | no | yes |
| ECLIPSE Ti2-U invertito | no | no | yes | yes | no | no | yes |
| ECLIPSE Ni-E verticale | no | yes | yes | yes | no | no | no |
| ECLIPSE Ni-U verticale | no | no | yes | yes | no | no | no |
| ECLIPSE FN1 verticale | no | yes | yes | yes | no | no | no |
*Questa riga si riferisce esclusivamente all'uso di ECLIPSE Ti2-E per l'imaging a campo ampio. Il Ti2-E è il supporto per microscopio consigliato per l'uso insieme agli altri sistemi elencati nella tabella.
Letteratura correlata
Discussione sull'imaging cellulare in tempo reale
L'arte e la scienza dell'imaging cellulare vivo
Gli obiettivi Nikon della serie a immersione in silicone. Ciascuno di questi obiettivi fornisce un NA elevato, una lunga distanza di lavoro e un collare di correzione con impostazioni dipendenti dalla temperatura.
L'imaging delle cellule vive richiede agli utenti di bilanciare attentamente le condizioni di imaging: l'obiettivo è raccogliere i dati essenziali minimi, che riducono al minimo la perturbazione del sistema modello. Sebbene si possa essere tentati di utilizzare una maggiore potenza di illuminazione, esposizioni della fotocamera più lunghe, ecc. per ottenere immagini con un rapporto segnale-rumore (SNR) più elevato, è importante capire che la fototossicità può compromettere l'integrità fisiologica e la continua vitalità del sistema. Inoltre, il fotobleaching impone un limite pratico al numero di fotoni che possono essere estratti da ciascun fluoroforo nel corso dell'esperimento.
Un altro fattore da considerare è la scelta dell'obiettivo. Le lenti dell'obiettivo ad olio ad alta apertura numerica (NA) possono funzionare bene per le funzioni di imaging vicino al vetrino coprioggetto in cellule piatte, ma soffrono di aberrazione sferica quando si fa imaging più a fondo nel campione campione. Ciò è dovuto al minor indice di rifrazione (RI) della cellula/mezzo di coltura rispetto al vetro/olio. Per applicazioni di imaging 3D e più profonde, si consiglia di utilizzare obiettivi che utilizzano supporti di immersione che corrispondono più strettamente al RI dell'ambiente di imaging, come acqua o silicone.
La serie di obiettivi CFI Apochromat Lambda S include una serie di obiettivi per immersione in acqua, incluso il CFI Plan Apochromat IR 60XC WI, che con NA = 1,27 ha il NA più alto per un obiettivo a immersione in acqua a di cui siamo a conoscenza. Nikon ha recentemente introdotto gli obiettivi della serie Silicone Immersion. Il silicone ha un RI di circa 1,4, che corrisponde più strettamente all'ambiente cellulare pur consentendo NA più elevati rispetto all'immersione in acqua. Questi obiettivi sono adatti per l'imaging di sistemi di coltura 3D come gli organoidi.
Ridurre al minimo la fototossicità e il fotosbiancamento nelle cellule vive
L'attivazione dell'hardware migliora significativamente il tempo complessivo dell'esperimento. Nella maggior parte di questi esempi, il tempo di esposizione della fotocamera era più lungo del tempo di lettura della fotocamera.
a L'ultima linea presenta un confronto per il quale il tempo di esposizione della fotocamera era uguale al suo tempo di lettura e la camera è stata in grado di funzionare in modalità sovrapposta (ciclo di lavoro al 100%).
L'intensa irradiazione richiesta dalle tecniche di imaging basate sulla fluorescenza è intrinsecamente dannosa per la salute delle cellule, specialmente con lunghezze d'onda a più alta energia (spostate verso il blu). Per questo motivo, si raccomanda l'uso di fluorofori da rosso a vicino infrarosso, sebbene l'uso continuato di popolari fluorofori verdi come EGFP non sia eccessivamente proibitivo e continui a funzionare bene per molte applicazioni di imaging multicolori.
La maggior parte dei microscopi utilizza l'attivazione del software dei dispositivi di sistema. Tuttavia, questo può essere alquanto lento a causa della relativa imprecisione dell'orologio del computer e dei controlli e delle richiamate richiesti degli stati del dispositivo. Al contrario, l'attivazione hardware utilizza il pixel clock della fotocamera ad alta precisione per coordinare i dispositivi bypassando i callback dei dispositivi, massimizzando così la velocità del sistema e riducendo al minimo la dose di fotoni. I dispositivi attivati possono includere stadi piezoelettrici Z, illuminatori laser/LED e persino dispositivi personalizzati con capacità di comunicazione I/O.
L'attivazione consente anche schemi di illuminazione più complessi. Ad esempio, è possibile utilizzare il software Nikon NIS-Elements per illuminare il campione solo quando tutti i pixel di una fotocamera sCMOS sono esposti (tenendo conto dell'effetto del rolling shutter), riducendo la dose di fotoni e il fotosbiancamento rispetto all'illuminazione continua e al in esecuzione l'acquisizione di immagini. È anche possibile pulsare l'illuminazione sulla scala temporale del microsecondo durante l'esposizione con vari illuminatori LED e laser. L'illuminazione pulsata su questa scala temporale consente ai fluorofori eccitati in uno stato di tripletta più tempo per rilassarsi allo stato fondamentale e quindi aiutare a evitare i principali percorsi di photobleaching.
Utilizzo dell'intelligenza artificiale basata sul deep learning per migliorare l'imaging di cellule vive
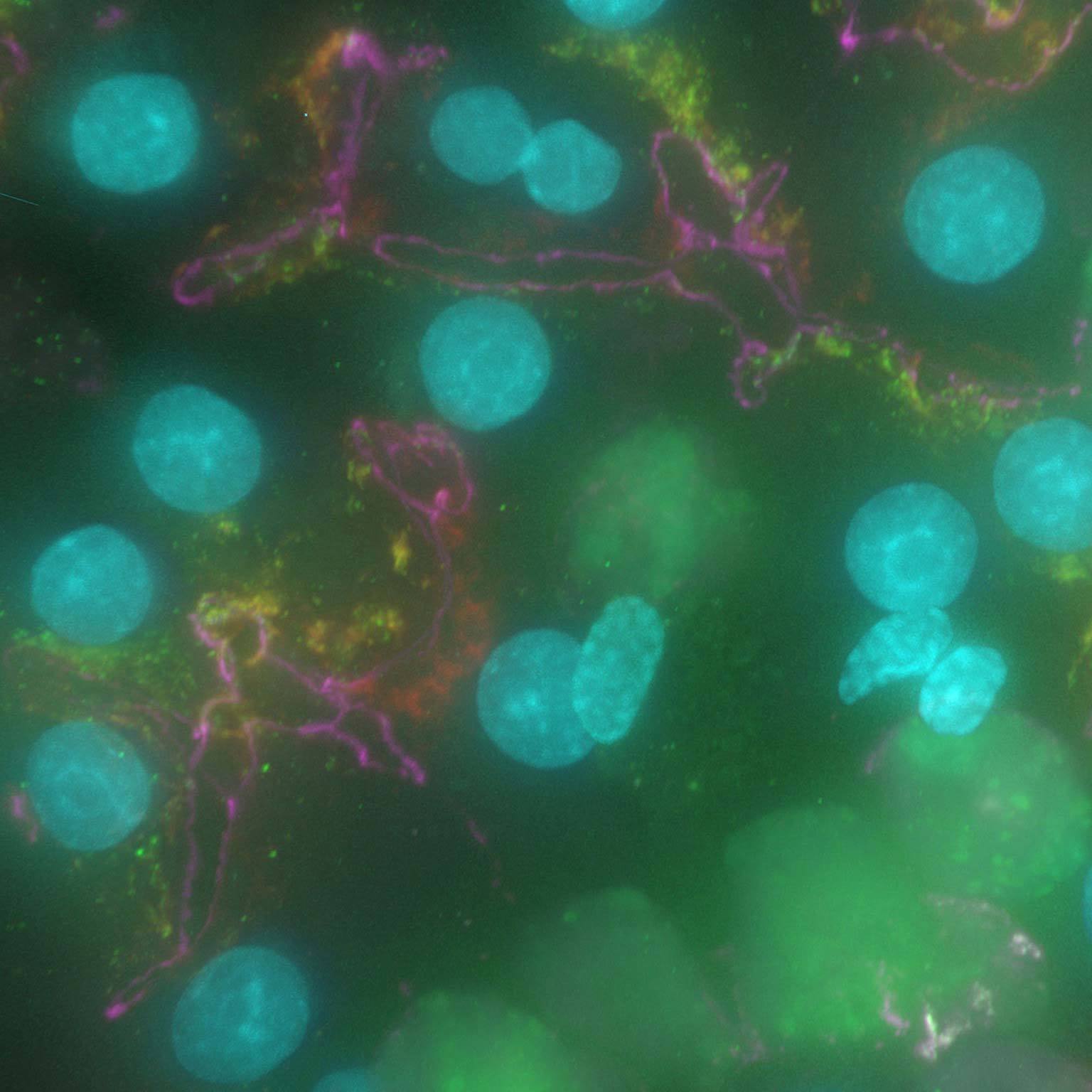
I dati a campo ampio possono essere contaminati da luce diffusa e sfocata, ma gli strumenti basati sull'intelligenza artificiale possono recuperare immagini ad alto contrasto rimuovendo rumore e sfocatura.
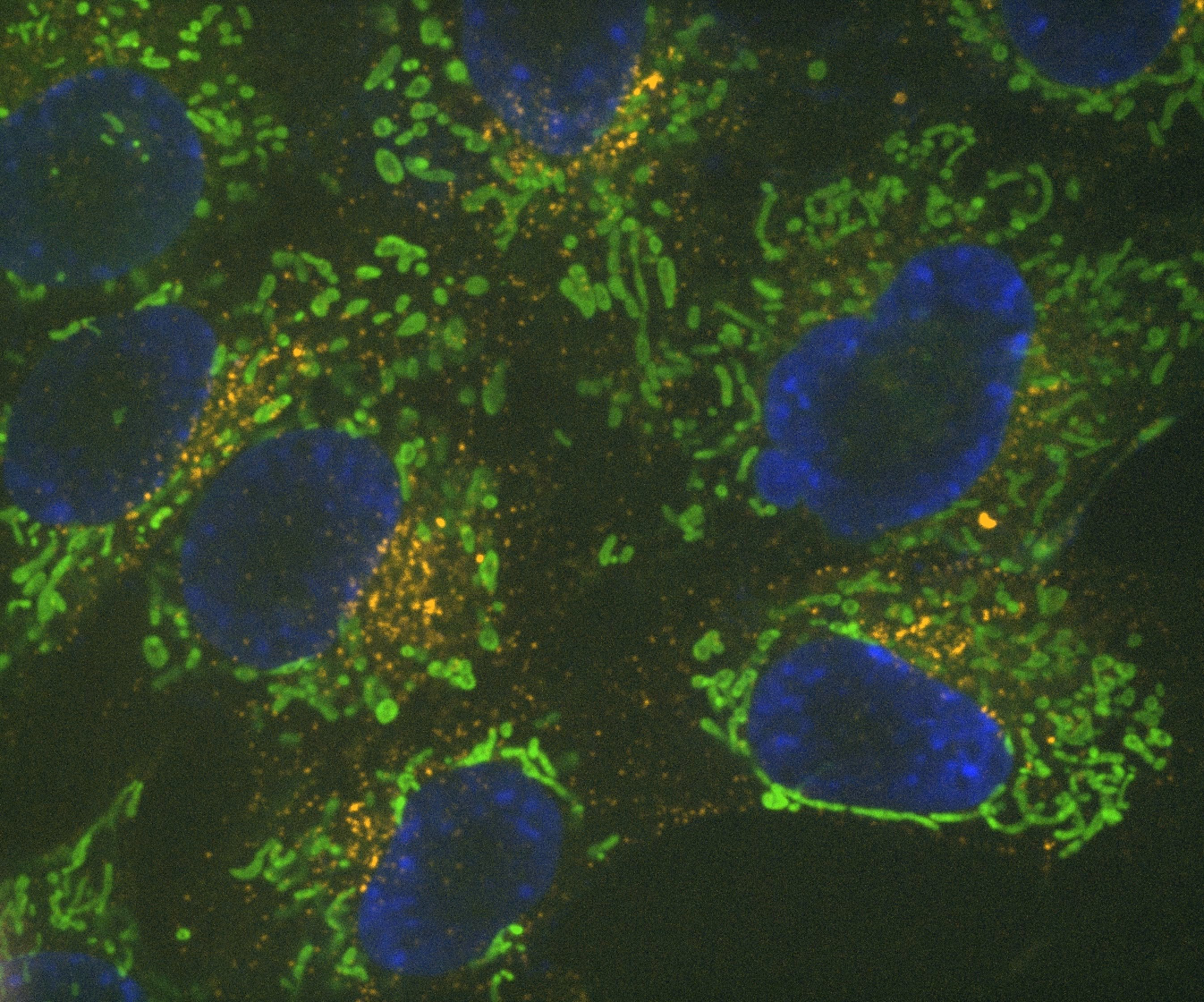
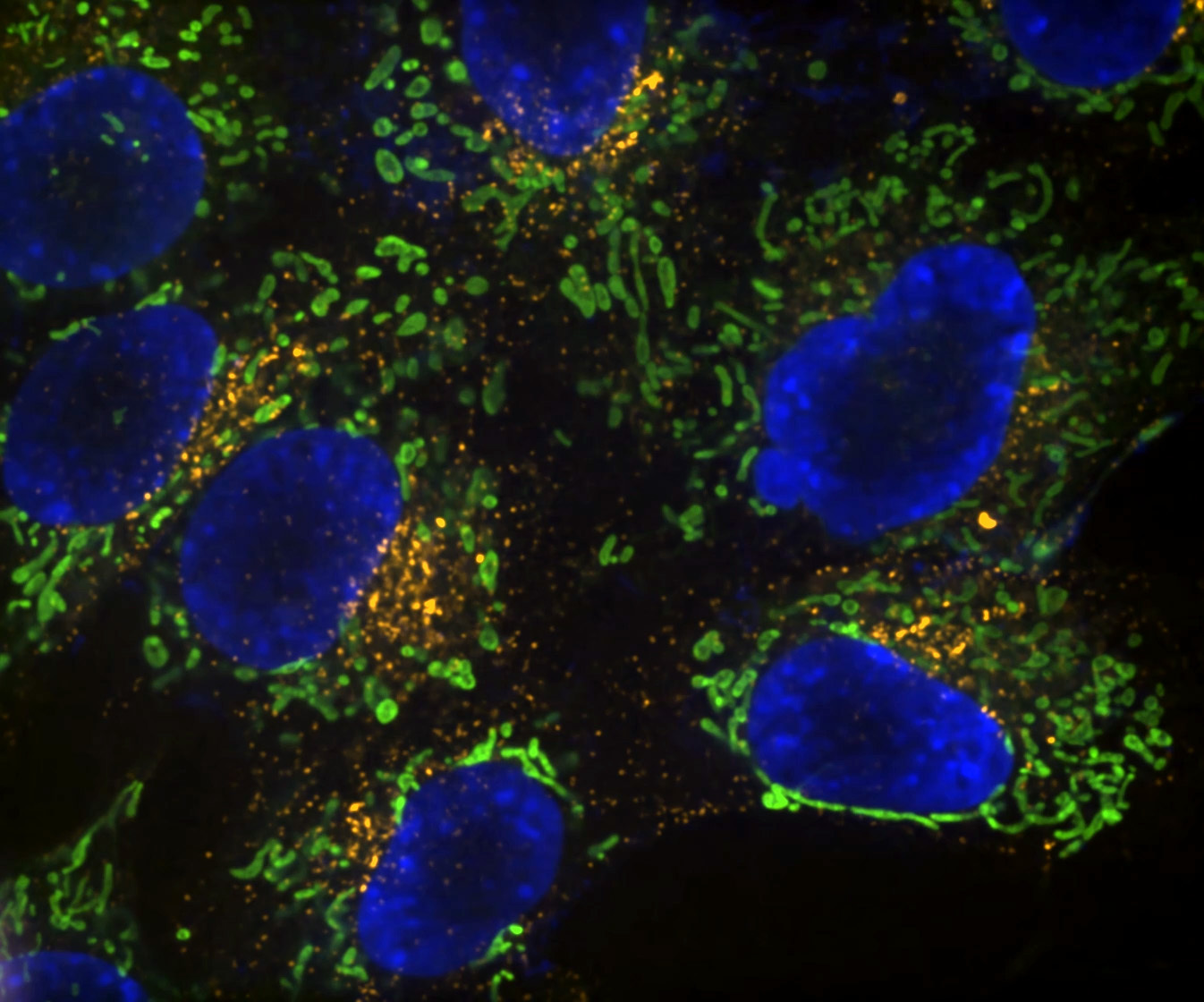
Denoise.ai può essere applicato per rimuovere la componente di rumore di ripresa delle immagini lasciando inalterati i valori di intensità e struttura sottostante.
L'avvento dei metodi di intelligenza artificiale (AI) per la microscopia ha aperto nuove possibilità per l'imaging di cellule vive con una dose ridotta di fotoni. I metodi basati sul deep learning si stanno rivelando adatti per saggi basati su immagini di campioni biologici. Nikon è impegnata nello sviluppo di soluzioni software stabili basate sul deep learning per varie applicazioni, disponibili come moduli NIS.ai per il nostro software NIS-Elements.
Clarify.ai fornisce la rimozione automatica della sfocatura dalle immagini a fluorescenza a campo ampio standard. Questo modulo è pre-addestrato di fabbrica e non richiede la regolazione manuale dell'immagine finale basata sull'utente, eliminando l'opportunità di soggettività. Clarify.ai consente quindi di eseguire il sezionamento ottico su immagini a campio ampio a piano singolo acquisite alla massima velocità di sistema, non richiedendo dati da più piani come con la deconvoluzione iterativa 3D di dati widefield.
Denoise.ai è un altro modulo pre-addestrato e utilizzato per rimuovere in tempo reale il rumore di Poisson (rumore dello scatto) dalle immagini confocali. Ciò consente tempi di esposizione ridotti ed è vantaggioso se utilizzato in combinazione con immagini di scansione risonanti acquisite utilizzando il microscopio confocale AX R, dove il rumore dello scatto è la fonte di rumore predominante.
Nikon offre anche il modulo Convert.ai per la previsione delle caratteristiche dell'immagine che vengono generalmente rilevate in un canale di fluorescenza, con il segnale previsto basato su un'immagine in campo chiaro corrispondente (ad esempio, la previsione dei pattern di colorazione nucleare DAPI dai dati dell'immagine DIC). Ciò consente l'eliminazione dei canali di imaging a fluorescenza, evitando l'illuminazione intensa richiesta dalle tecniche di fluorescenza. Le tecniche di imaging in campo chiaro sono intrinsecamente meno fototossiche.
Enhance.ai può essere addestrato per prevedere i dettagli nelle immagini a basso segnale-rumore (SNR), migliorando efficacemente l'SNR e consentendo l'imaging con dose di fotoni ridotta e fotobleaching.
Quale tecnica di contrasto è giusta per la tua ricerca?
Immagine a fluorescenza ad ampio campo di un glomerulo renale di topo in una sezione di tessuto spessa 16 mm prima (a) e dopo (b) la deconvoluzione iterativa 3D nel software NIS-Elements.
Per campioni bidimensionali relativamente piatti, come cellule aderenti coltivate in vitro, l'imaging a fluorescenza ad ampio campo può essere sufficiente. I casi d'uso e i tipi di campione compatibili sono molto più ampi quando si combinano l'imaging a campo largo con l'analisi di deconvoluzione o la sfocatura automatica utilizzando il modulo software Clarify.ai.
L'imaging confocale diventa necessario quando si visualizzano campioni di spessore superiore a ~20 μm, ma sono utili anche per l'imaging ad alta risoluzione di campioni anche di pochi μm di spessore. Gli strumenti confocali a disco rotante sono veloci e adatti a campioni fino a ~50 μm (con il CSU-W1 in grado di acquisire immagini più profonde rispetto ad altri modelli grazie alla maggiore spaziatura tra i fori stenopeici). Entrambi i sistemi sono applicabili all'imaging di diversi tipi di sistemi di coltura cellulare 3D, come organoidi e sferoidi.
L'imaging confocale a point-scanning è in grado di acquisire immagini più profonde, fino a diverse centinaia di μm. Lo scanner risonante presente sul confocale AX R è in grado di fornire immagini della velocità video ed è concepito per la combinazione con Denoise.ai per la rimozione del rumore di ripresa in tempo reale. A differenza dei sistemi a disco rotante, l'AX R è dotato di un pinhole regolabile in modo continuo per l'ottimizzazione del sezionamento ottico e della risoluzione con qualsiasi obiettivo compatibile.
L'imaging a fluorescenza a riflessione interna totale (TIRF) è una tecnica di sezionamento ottico che consente l'osservazione esclusiva delle caratteristiche cellulari che si verificano entro poche centinaia di nm dall'interfaccia cellula-vetrino. Ciò fornisce un miglioramento dell'SNR, consentendo l'uso di una potenza laser inferiore per proteggere la salute delle cellule e/o massimizzare la velocità di imaging. Gli obiettivi della serie CFI Apochromat TIRF di Nikon presentano anche un NA molto elevato di 1,49.
Le tecniche di microscopia a super risoluzione sono per le situazioni in cui è specificamente richiesta una risoluzione ottica oltre il limite di diffrazione per risolvere i dettagli necessari. La microscopia a super risoluzione delle cellule vive è stata generalmente una sfida a causa dei compromessi richiesti da queste varie tecniche per migliorare la risoluzione. Yokogawa CSU-W1 SoRa è un sistema a super risoluzione implementato nel contesto di un sistema confocale a disco rotante, che consente di acquisire immagini a velocità corrispondenti al solo CSU-W1 (assumendo un segnale sufficiente).
Sebbene le tecniche di imaging a fluorescenza siano potenti, consentendo il rilevamento multiplo di bersagli molecolari distinti, le tecniche di imaging in campo chiaro come il contrasto di fase e il contrasto di interferenza differenziale (DIC) forniscono immagini cellulari dettagliate con una dose di fotoni significativamente inferiore. Sebbene tali tecniche possano mancare della specificità molecolare richiesta, è buona norma acquisire immagini in campo chiaro occasionali per aiutare a valutare la salute delle cellule nel corso dell'esperimento.
Glossario
- Campo visivo
- Il campo visivo del sistema, indicato anche come numero di campo, è il diametro dell'area di imaging con un ingrandimento nominale di 1X.
- Limite di profondità di imaging relativo
- Ciò indica l'intervallo di profondità Z (assiale) approssimativo entro il quale il sistema indicato può fornire immagini con qualità di sezionamento ottico e rapporto segnale-rumore sufficienti. Questo valore può essere abbastanza variabile e dipende fortemente dalle proprietà ottiche del campione e del recipiente, nonché dall'etichettatura.
- Modalità di imaging supportate
- Questo si riferisce alle varie tecniche di imaging di microscopia fornite da ciascun sistema. Si noti che è ancora possibile accedere a quasi tutte le modalità di imaging supportate dal microscopio invertito ECLIPSE Ti2-E quando viene utilizzato come base per uno qualsiasi degli altri sistemi elencati in questa tabella.
- Supporta l’imaging video-rate
- La “velocità video” è tradizionalmente definita come circa 30 fotogrammi al secondo (FPS). La velocità di imaging ottimale dipende dall'applicazione esatta e può essere più veloce o più lenta di 30 FPS. Le camere EM-CCD possono acquisire generalmente immagini fino a 60 FPS (full frame) e le telecamere sCMOS fino a 40-100 FPS (full frame).
- Supporti per microscopio compatibili
- Questo si riferisce ai modelli di supporto per microscopio Nikon compatibili con ciascun sistema.
- Casa
- Applicazioni
- Scienze della vita
- Imaging cellulare dal vivo