- fr Change Region
- Global Site
- Accueil
- Applications
- Sciences de la vie
- Imagerie de l'organisme entier et des tissus
Imagerie de l'organisme entier et des tissus
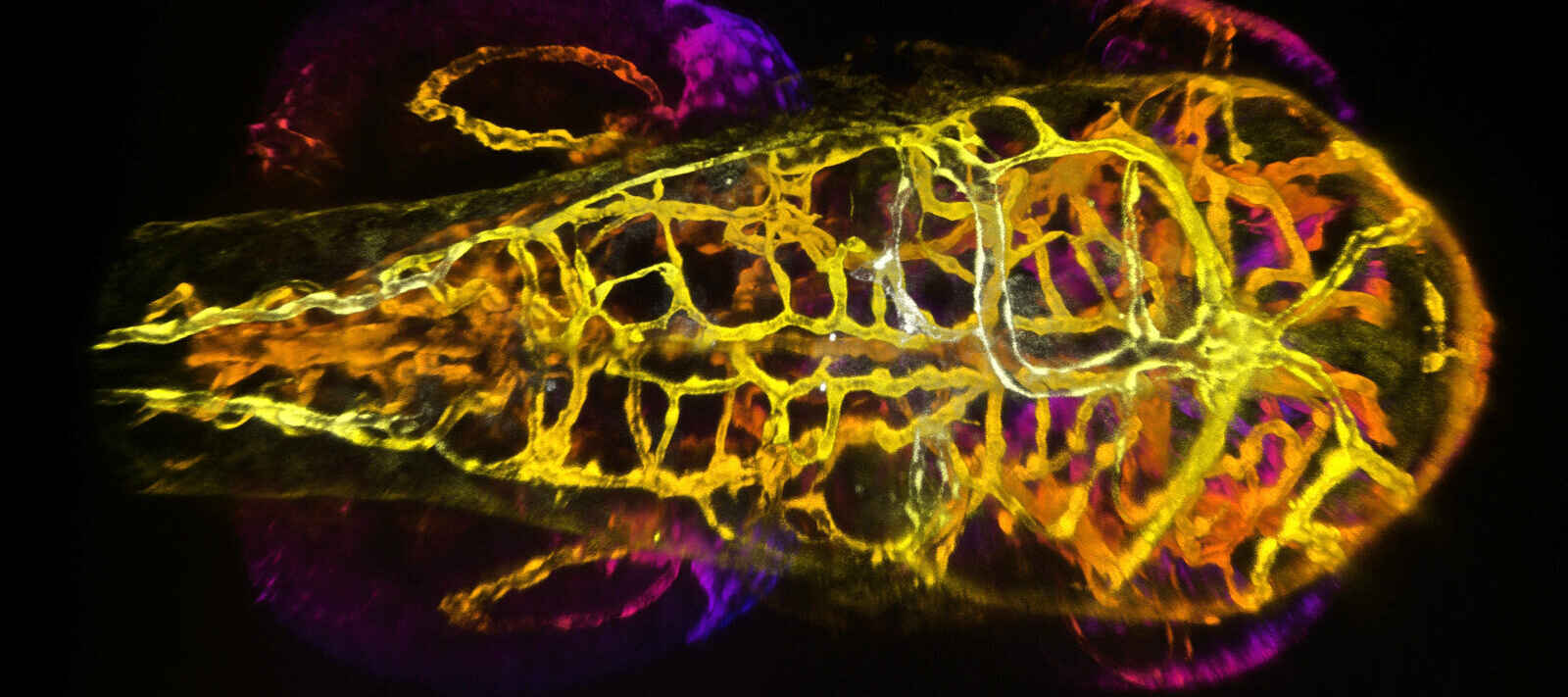
L'imagerie en profondeur dans des organismes, des organes et des tissus entiers est l'un des plus grands défis posés au microscopiste optique. Les échantillons biologiques sont des environnements optiquement imparfaits - diffusant à la fois l'éclairage et la lumière de détection. La diffusion et diverses aberrations optiques s'aggravent progressivement avec l'augmentation de la distance dans l'échantillon, imposant finalement une limite pratique à la profondeur d'imagerie possible.
Produits pour l'imagerie d’organisme entier et de tissu
Poisson-zèbre embryonnaire
20X LWD 1.0 NA WD 2.8mm Avec l'aimable autorisation d'Erika Dreikorn et du Dr Beth Roman, Département de génétique humaine, École supérieure de santé publique de l'Université de Pittsburgh.
La principale solution de Nikon pour les applications d'imagerie profonde est le système de microscope multiphotonique AX R MP. Ce système prend en charge des longueurs d'onde d'excitation allant jusqu'à 1300 nm, permettant une imagerie aussi profonde que 1,4 mm dans l'échantillon. Il est également possible de balayer simultanément avec deux faisceaux, ce qui accélère l'acquisition d'images multiphotoniques multicolores.
Pour l'imagerie à des profondeurs allant jusqu'à environ quelques centaines de micromètres (µm), Nikon propose le système de microscope confocal AX / AX R. La détection confocale avec un seul sténopé, comme avec l'AX / AX R, permet un meilleur rejet de la lumière hors foyer et une section optique par rapport aux instruments confocaux utilisant un réseau de sténopés.
Le système confocal à disque rotatif Yokogawa CSU-W1 est optimisé pour l'imagerie de spécimens plus grands que la plupart des instruments à disque rotatif, avec un espacement plus large entre les sténopés dans le disque rotatif pour réduire la diaphonie des sténopés - une fonctionnalité utile pour les applications d'imagerie profonde.
●: Inclus, ⚬: Optionnel
| AX R MP Système de microscope multiphotonique |
AX / AX R Système de microscope confocal |
CSU-W1 Scanner confocal à disque rotatif |
|
|---|---|---|---|
| Champ de vision | Diagonale de 22 mm (carré) | Diagonale de 22 mm (carré) | 17 x 16 mm (rectangulaire) |
| Limite de profondeur d'imagerie relative | ~ 1.4 mm (with 1300 nm excitation) | ~ 100 – 500 μm | ~ 50 – 100 μm |
| Prend en charge l'imagerie de débit vidéo | Oui (30 FPS avec numérisation 512 x 512) |
Oui (30 FPS avec numérisation 512 x 512 ; AX R uniquement) |
Oui (limité par le système de caméra et la vitesse de rotation du disque) |
| Options du détecteur | Détecteurs GaAsP non-descannés (NDD), jusqu'à 4 canaux. | Détecteurs à tubes photomultiplicateurs (PMT) GaAsP et multi-alcalis disponibles. Jusqu'à 4 canaux. | Caméras monochromes sCMOS ou EM-CCD recommandées. Options multi-caméras et séparateur de caméras disponibles. |
| Supports de microscope compatibles | AX R MP | AX / AX R | CSU-W1 |
| ECLIPSE Ti2-E Inversé | yes | yes | yes |
| ECLIPSE Ti2-A Inversé | no | no | yes |
| ECLIPSE Ti2-U Inversé | no | no | yes |
| ECLIPSE Ni-E Droit | no | yes | yes |
| ECLIPSE Ni-U Droit | no | no | yes |
| FN1 Droit | no | yes | yes |
| AX-FNGP Droit | yes | no | no |
| AX-FNSP Droit | yes | no | no |
Littérature reliée
Discussion sur l'imagerie d’organisme entier et de tissu
Nettoyage des tissus et objectifs compatibles
Nettoyage des tissus
Circuit auditif du tronc cérébral du poussin rendu transparent avec le protocole CUBIC. (E17) Colorant : Tetbow (transactivateur de tétracycline Brainbow) CFI Plan Apochromat 10XC Glyc
Dr Ryo Egawa, Dr Hiroshi Kuba Physiologie Cellulaire Faculté de Médecine graduée Université de Nagoya
Le développement renouvelé des méthodes de compensation optique pour augmenter la transparence des tissus biologiques a permis une meilleure observation d'échantillons plus grands et plus complexes. Dans le même ordre d'idées, les méthodes de préparation d'échantillons par microscopie d'expansion à super-résolution augmentent physiquement la taille de l'échantillon, généralement d'un facteur d'environ 4 à 10 fois ou plus, et exigent donc également des instruments adaptés à l'imagerie profonde.
Lors de l'observation d'échantillons épais au microscope, il est primordial de minimiser la différence entre l'indice de réfraction de l'échantillon et celui du milieu d'immersion afin d'atténuer au mieux l'aberration sphérique, qui limite la qualité de l'image et la distance de travail utilisable. Nikon propose des objectifs pour l'imagerie d'échantillons transparents qui peuvent être directement immergés dans une variété de milieux de transparence et comprennent des colliers de correction pour l'indice de réfraction (IR). Ces objectifs présentent également de longues distances de travail, des ouvertures numériques élevées, etc.
Nikon produit également sa série d'objectifs Silicone Immersion, CFI75 Water Dipping Series et Lambda S Objective Series (la dernière catégorie comprend plusieurs objectifs à immersion dans l'eau). Les lentilles utilisant du silicone, de l'eau et de la glycérine sont généralement plus faciles à associer aux supports de nettoyage et de montage courants, qui ont généralement un RI inférieur à l'huile mais supérieur à l'air.
Stratégies d'éclairage pour une imagerie plus profonde
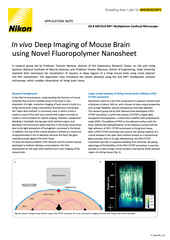
Imagerie in vivo d'une souris YFP-H anesthésiée (âgée de 4 semaines) par la méthode du crâne ouvert. Visualisation de l'ensemble des neurones pyramidaux de la couche V et des neurones hippocampiques plus profonds. Imagerie profonde réalisée pour l'imagerie tridimensionnelle des dendrites de l'hippocampe jusqu'à 1,4 mm dans le cerveau.
Capturé avec épiscopique GaAsP NDD pour 1300 nm et objectif CFI75 Apochromat 25XC W 1300 (NA 1.10, WD 2.0 mm), longueur d'onde d'excitation : 1040 nm
Photographié avec la coopération de : Drs. Ryosuke Kawakami, Terumasa Hibi et Tomomi Nemoto, Institut de recherche en sciences électroniques, Université d'Hokkaido
Il existe des stratégies au-delà du simple filtrage spatial de la lumière, comme avec un microscope confocal, pour améliorer la capacité d'imagerie plus profonde. Une approche, qui peut être mise en œuvre sur n'importe quel microscope à fluorescence, consiste à utiliser des sondes avec des spectres d'excitation et d'émission plus décalés vers le rouge. La lumière de longueur d'onde plus longue est moins diffusée et convient donc à l'imagerie profonde. L'imagerie du spectre rouge lointain et proche infrarouge (NIR) est possible sur les séries d'instruments confocaux AX / AX R et CSU-W1.
Les avantages de l'utilisation d'un éclairage à longueur d'onde plus longue sont aggravés lorsqu'ils sont combinés à une excitation multiphotonique - le processus par lequel un fluorophore qui est généralement excité par un photon d'une énergie/longueur d'onde donnée peut à la place être excité par deux photons ou plus à longueur d'onde plus longue avec une énergie totale similaire. Ce processus est presque inexistant dans la nature car la probabilité que plusieurs photons de l'énergie correcte soient absorbés par un fluorophore à peu près au même instant est extrêmement faible.
En pratique, la réalisation d'une excitation multiphotonique nécessite un laser pulsé à la femtoseconde de très haute puissance, et même encore la densité de puissance est seulement assez élevée pour exciter la fluorescence au foyer du faisceau. Cela élimine essentiellement l'excitation de fluorescence hors foyer et évite plus ou moins le besoin d'une ouverture en sténopé pour filtrer l'émission hors foyer. Bien qu'une ouverture en sténopé puisse toujours être utilisée pour aider à améliorer la section optique, il est généralement préférable de maximiser le signal détecté, car la diffusion et d'autres problèmes subsistent.
Glossaire
- Champ de vision
- Le champ de vision du système, également appelé numéro de champ, est le diamètre de la zone d'imagerie à un grossissement nominal de 1X.
- Limite de profondeur d'imagerie relative
- Cela indique la plage de profondeur Z (axiale) approximative dans laquelle le système indiqué peut fournir des images avec une qualité de sectionnement optique et un rapport signal/bruit suffisants. Cette valeur peut être assez variable et dépend fortement des propriétés optiques de l'échantillon et du récipient, ainsi que du marquage.
- Options du détecteur
- Les systèmes multiphotoniques et confocaux à balayage ponctuel utilisent généralement des détecteurs à élément unique, tels que des tubes photomultiplicateurs (PMT), tandis que les instruments confocaux à disque tournant et à champ large utilisent des appareils photo numériques.
- Prend en charge l'imagerie de débit vidé
- Le « débit vidéo » est traditionnellement défini comme environ 30 images par seconde (FPS). Le taux d'imagerie optimal dépend de l'application exacte et peut être plus rapide ou plus lent que 30 FPS. Les caméras EM-CCD peuvent généralement imager jusqu'à 60 FPS (plein cadre) et les caméras sCMOS jusqu'à 40-100 FPS (plein cadre).
- Supports de microscope compatibles
- Il s'agit des modèles de supports de microscope Nikon compatibles avec chaque système.
- Accueil
- Applications
- Sciences de la vie
- Imagerie de l'organisme entier et des tissus