- fr Change Region
- Global Site
- Accueil
- Applications
- Sciences de la vie
- Imagerie de cellules vivantes
Imagerie de cellules vivantes
Il est difficile de sous-estimer l'importance de la microscopie des cellules vivantes - en particulier l'imagerie en fluorescence - pour la recherche moderne en biologie cellulaire. L'imagerie en fluorescence des cellules vivantes permet d'observer la dynamique et les interactions de biomolécules spécifiques sur de longues périodes. De nombreuses innovations technologiques au cours des dernières décennies ont contribué à l'utilité de l'imagerie en direct, y compris le développement de protéines fluorescentes sous forme de marquages génétiquement exprimés et spécifiques. L'imagerie des cellules vivantes est généralement effectuée à l'aide d'un microscope inversé pour mieux s'adapter aux récipients de culture/imagerie remplis de milieu.
Produits pour l'imagerie des cellules vivantes
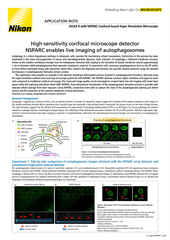
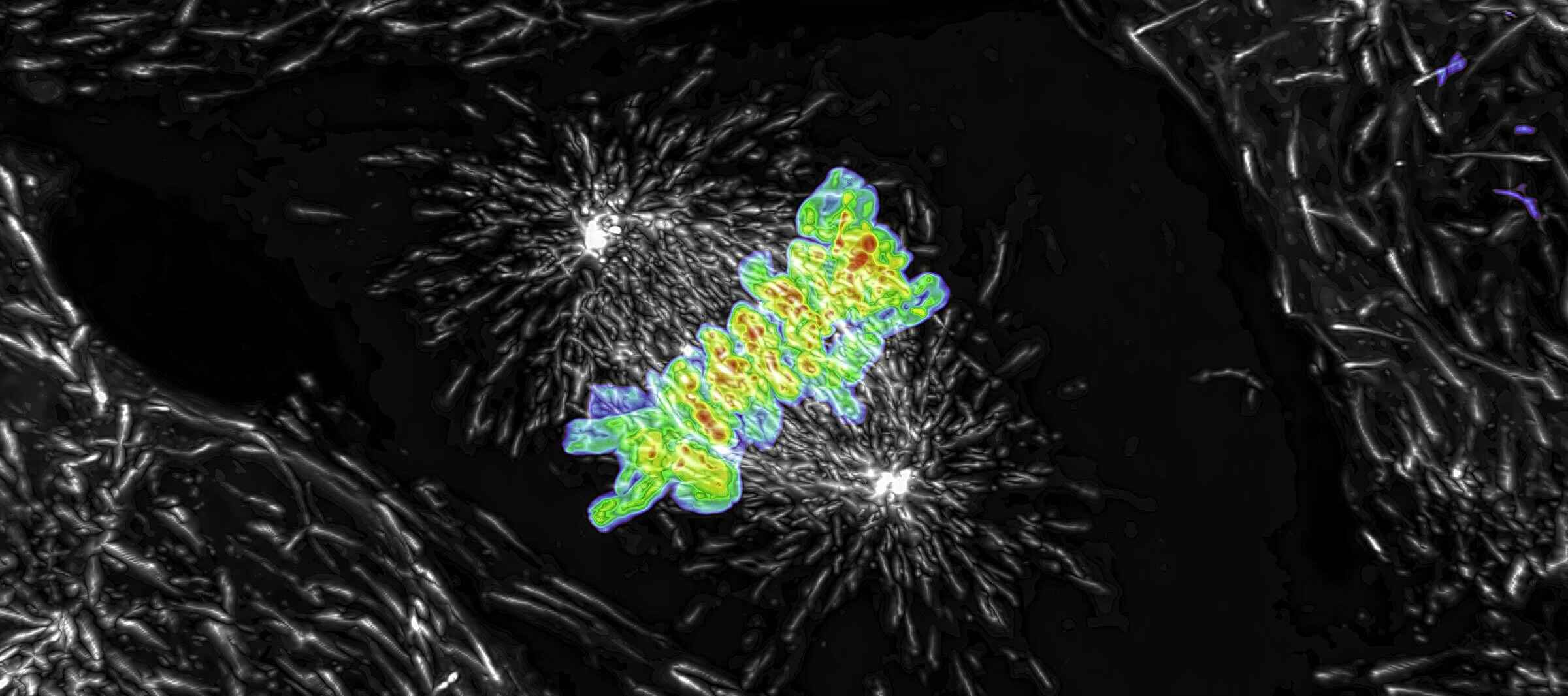
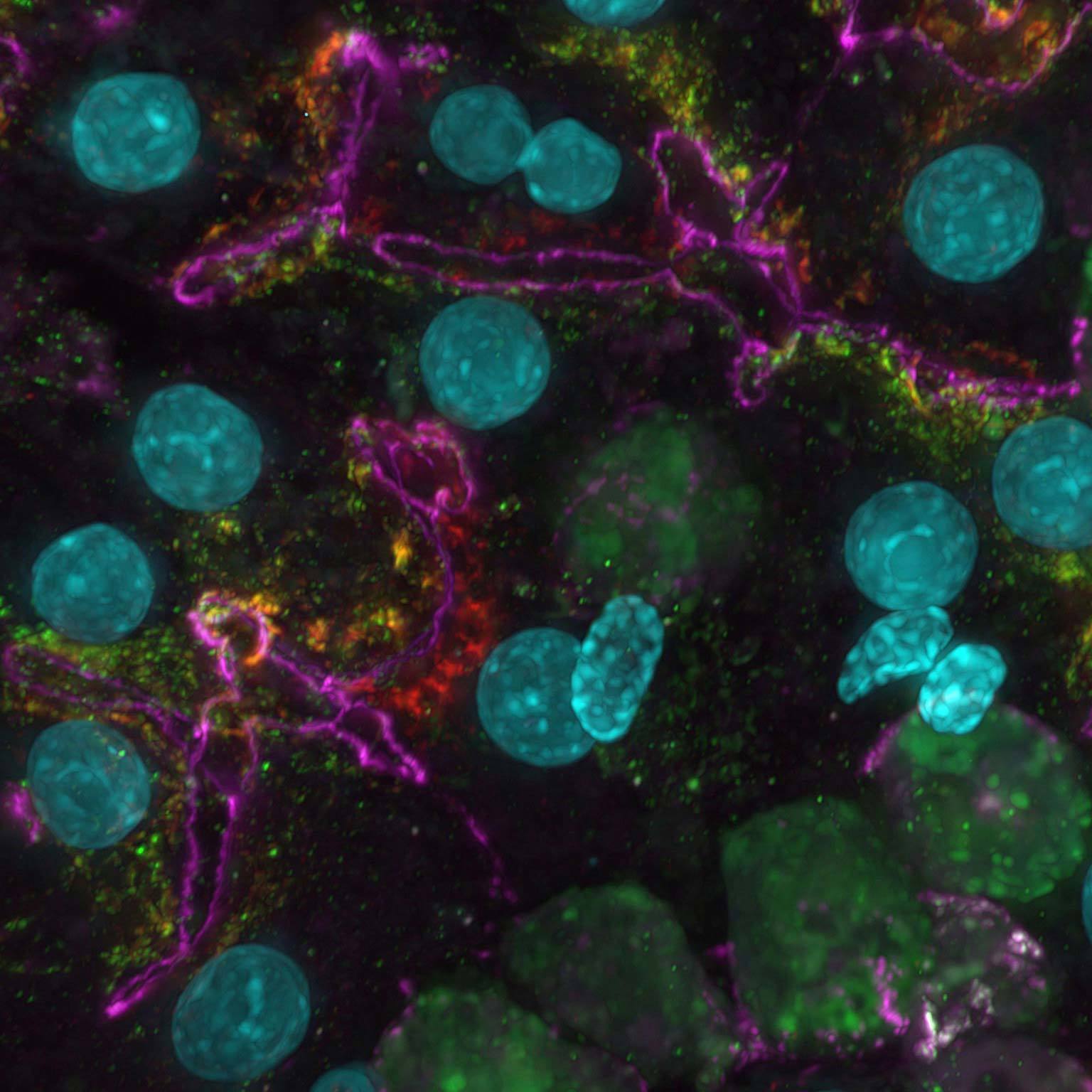
Projection d'intensité maximale d'une pile Z collectée d'une cellule mitotique vivante, acquise à l'aide du scanner résonant AX R fonctionnant à 15 FPS et une résolution de pixels de 2048 x 1024. L'objectif était un CFI Plan Apo Lambda 60X à immersion dans l’huile, 1,4 NA
Le microscope inversé motorisé ECLIPSE Ti2-E est le support de microscope recommandé pour l'imagerie de cellules vivantes - il peut être combiné avec toutes les options confocales et de super-résolution détaillées ici. Le Perfect Focus System 4 (PFS4) est la principale technologie matérielle de verrouillage de la mise au point de l'industrie, permettant une imagerie à long terme des cellules vivantes sans dérive focale et compatible avec les récipients de culture en verre et en plastique. Un distributeur d'eau automatique pour objectifs à immersion dans l'eau est également disponible.
Le système d'éclairage modulaire Ti2-LAPP sont les solutions confocales à balayage laser de Nikon - avec l'AX R doté d'un système de balayage résonnant rapide qui prend en charge l'imagerie à fréquence vidéo de 30 images par seconde (FPS) à 512 x 512 pixels. Ceci est en outre pris en charge par le module logiciel Denoise.ai, qui supprime automatiquement le bruit de tir - la principale source de bruit dans les images confocales à balayage résonant.
Les microscopes confocaux AX / AX R confocal microscopes are Nikon’s point-scanning confocal solutions – with the AX R featuring a fast resonant-scanning system that supports video rate imaging of 30 frames per second (FPS) at 512 x 512-pixel. This is further supported by the Denoise.ai software module, which automatically removes shot noise – the major source of noise in resonant scanning confocal images.
Les systèmes confocaux à disque rotatif de la série Yokogawa CSU sont des solutions populaires pour l'imagerie des cellules vivantes. Le CSU-W1 est meilleur pour l'imagerie de systèmes modèles plus épais, tels que les organoïdes, en raison de l'espacement plus large entre les sténopés, ce qui réduit la diaphonie du signal entre les sténopés adjacents, permettant une imagerie plus profonde dans les échantillons de diffusion.
La microscopie à super-résolution continue de devenir plus raffinée et pratique pour les applications d'imagerie de cellules vivantes. Les modes 2D-SIM, 3D-SIM et TIRF-SIM sont tous disponibles. Le Yokogawa CSU-W1 SoRa est un instrument confocal à disque rotatif qui intègre un disque à microlentilles d'émission pour réaliser une super-résolution par réaffectation optique des pixels.
●: Inclus, ⚬: Optionnel
| ECLIPSE Ti2-E Microscope inversé (imagerie à champ large)* |
AX R Système confocal résonnant |
CSU-X1 Scanner confocal à disque rotatif |
CSU-W1 Scanner confocal à disque rotatif |
Ti2-LAPP E-TIRF Illuminateur |
CSU-W1 SoRa Système de super-résolution à disque rotatif |
|
|---|---|---|---|---|---|---|
| Limite de profondeur d'imagerie relative | ~ 5 μm ~ 15 – 25 μm (avec déconvolution) |
~ 100 – 500 μm | ~ 50 μm | ~ 50 – 100 μm | ~ 100 – 300 nm | ~ 50 – 100 μm |
| Prend en charge l'imagerie de débit vidéo | Oui |
Oui (30 FPS avec numérisation 512 x 512) |
Oui |
Oui (limité par le système de caméra et la vitesse de rotation du disque) |
Non (limité par le système de caméra) |
Oui (limité par le système de caméra et la vitesse de rotation du disque) |
| Champ de vision | Diagonale de 25 mm (circulaire) | 25 mm de diagonale (carré) | 10 x 7 mm (rectangulaire) | 17 x 16 mm (rectangulaire) | ~ 10 mm diagonale (circulaire) | 17 x 16 mm (rectangulaire) |
| Modalités d'imagerie prises en charge | ECLIPSE Ti2-E | AX R | CSU-X1 | CSU-W1 | Ti2-LAPP E-TIRF | CSU-W1 SoRa |
| Champ lumineux | yes | no | no | no | no | no |
| Confocal - Laser | no | yes | no | no | no | no |
| Confocal - Disque tournant | no | no | yes | yes | no | yes |
| Darkfield | yes | no | no | no | no | no |
| Contraste d'interférence différentielle (DIC) | yes | no | no | no | no | no |
| Contraste de modulation avancé Nikon (NAMC) | yes | no | no | no | no | no |
| Contraste de phase | yes | no | no | no | no | no |
| Super-résolution - Microscopie optique de réaffectation de pixels | no | no | no | no | no | yes |
| Fluorescence par réflexion interne totale (TIRF) | no | no | no | no | yes | no |
| Fluorescence à champ large | yes | no | no | no | no | no |
| Supports de microscope compatibles | ECLIPSE Ti2-E | AX R | CSU-X1 | CSU-W1 | Ti2-LAPP E-TIRF | CSU-W1 SoRa |
| Inversé Ti2-E | no | yes | yes | yes | yes | yes |
| Inversé ECLIPSE Ti2-A | no | no | yes | yes | no | yes |
| Inversé ECLIPSE Ti2-U | no | no | yes | yes | no | yes |
| ECLIPSE Ji Digital Inverted | no | yes | no | no | no | no |
| Droit ECLIPSE Ni-E | no | yes | yes | yes | no | no |
| Droit ECLIPSE FN1 | no | yes | yes | yes | no | no |
*Cette ligne se réfère uniquement à l'utilisation de l'ECLIPSE Ti2-E pour l'imagerie sur grand champ. Le Ti2-E est le support de microscope recommandé pour une utilisation avec les autres systèmes répertoriés dans le tableau.
Littérature reliée
Discussion sur l'imagerie des cellules vivantes
L'art et la science de l'imagerie des cellules vivantes
Les objectifs de la série Nikon Silicone Immersion. Chacune de ces lentilles offre une NA élevée, une longue distance de travail et un collier de correction avec des réglages dépendant de la température.
L'imagerie des cellules vivantes oblige les utilisateurs à équilibrer soigneusement les conditions d'imagerie - l'objectif est de collecter les données essentielles minimales, ce qui minimise la perturbation du système modèle. Bien qu'il puisse être tentant d'utiliser plus de puissance d'éclairage, des expositions de caméra plus longues, etc. pour obtenir des images à rapport signal- bruit (SNR) plus élevé, il est important de comprendre que la phototoxicité peut compromettre l'intégrité physiologique et la viabilité continue du système. De plus, le photoblanchiment impose une limite pratique au nombre de photons pouvant être extraits de chaque fluorophore au cours de l'expérience.
Un autre facteur à considérer est le choix de l'objectif. Les objectifs à huile à ouverture numérique élevée (NA) peuvent bien fonctionner pour les caractéristiques d'imagerie près de la lamelle dans les cellules plates, mais souffrent d'aberration sphérique plus les images sont profondes dans l'échantillon. Cela est dû à l'indice de réfraction inférieur (RI) de la cellule/milieu de culture par rapport au verre/huile. Pour les applications d'imagerie plus profondes et 3D, il est recommandé d'utiliser des objectifs qui utilisent des supports d'immersion correspondant plus étroitement à l'IR de l'environnement d'imagerie, comme l'eau ou le silicone.
La série d'objectifs CFI Apochromat Lambda Scomprend un certain nombre d'objectifs à immersion dans l'eau, y compris le CFI Plan Apochromat IR 60XC WI, qui a le NA le plus élevé pour un objectif à immersion dans l'eau à NA = 1,27 que nous connaissons. Nikon a récemment présenté ses objectifs de la série Silicone Immersion. Le silicone a un RI d'environ 1,4, correspondant plus étroitement à l'environnement cellulaire tout en permettant des NA plus élevées que l'immersion dans l'eau. Ces objectifs sont adaptés à l'imagerie des systèmes de culture 3D tels que les organoïdes.
Minimiser la phototoxicité et le photoblanchiment dans les cellules vivantes
Le déclenchement matériel améliore considérablement la durée globale de l'expérience. Dans la plupart de ces exemples, le temps d'exposition de la caméra était plus long que le temps de lecture de la caméra.
a La dernière ligne présente une comparaison pour laquelle le temps d'exposition de la caméra était le même que son temps de lecture, et la caméra a pu fonctionner en mode superposé (cycle de service de 100 %).
L'irradiation intense requise par les techniques d'imagerie basées sur la fluorescence est intrinsèquement nocive pour la santé des cellules, en particulier avec des longueurs d'onde à énergie plus élevée (décalées vers le bleu). Pour cette raison, l'utilisation de fluorophores du rouge au proche infrarouge est recommandée, bien que l'utilisation continue de fluorophores verts populaires tels que l'EGFP ne soit pas trop prohibitive et continue de bien fonctionner pour de nombreuses applications d'imagerie multicolores.
La plupart des microscopes utilisent le déclenchement logiciel des dispositifs du système. Cependant, cela peut être quelque peu lent en raison de l'imprécision relative de l'horloge de l'ordinateur et des vérifications et rappels requis des états des périphériques. À l'inverse, le déclenchement matériel utilise l'horloge de pixel de la caméra de haute précision pour coordonner les appareils tout en contournant les rappels d'appareils, maximisant ainsi la vitesse du système tout en minimisant la dose de photons. Les dispositifs déclenchés peuvent inclure des plateformes piézoélectriques Z, des illuminateurs laser/DEL et même des dispositifs personnalisés dotés d'une capacité de communication E/S.
Le déclenchement permet également des motifs d'éclairage plus complexes. Par exemple, il est possible d'utiliser le logiciel Nikon NIS-Elements pour éclairer l'échantillon uniquement lorsque tous les pixels d'une caméra sCMOS sont exposés (en tenant compte de l'effet de l'obturateur roulant) - diminution de la dose de photons et du photoblanchiment par rapport à l'éclairage continu et libre- acquisition d'images en cours. Il est également possible d'impulsions d'éclairage sur l'échelle de temps de la microseconde pendant l'exposition avec divers illuminateurs DEL et laser. L'éclairage pulsé sur cette échelle de temps permet aux fluorophores excités à un état triplet de plus de temps pour se détendre à l'état fondamental, et ainsi aider à éviter les principales voies de photoblanchiment.
Utilisation de l'intelligence artificielle basée sur le Deep Learning pour améliorer l'imagerie des cellules vivantes
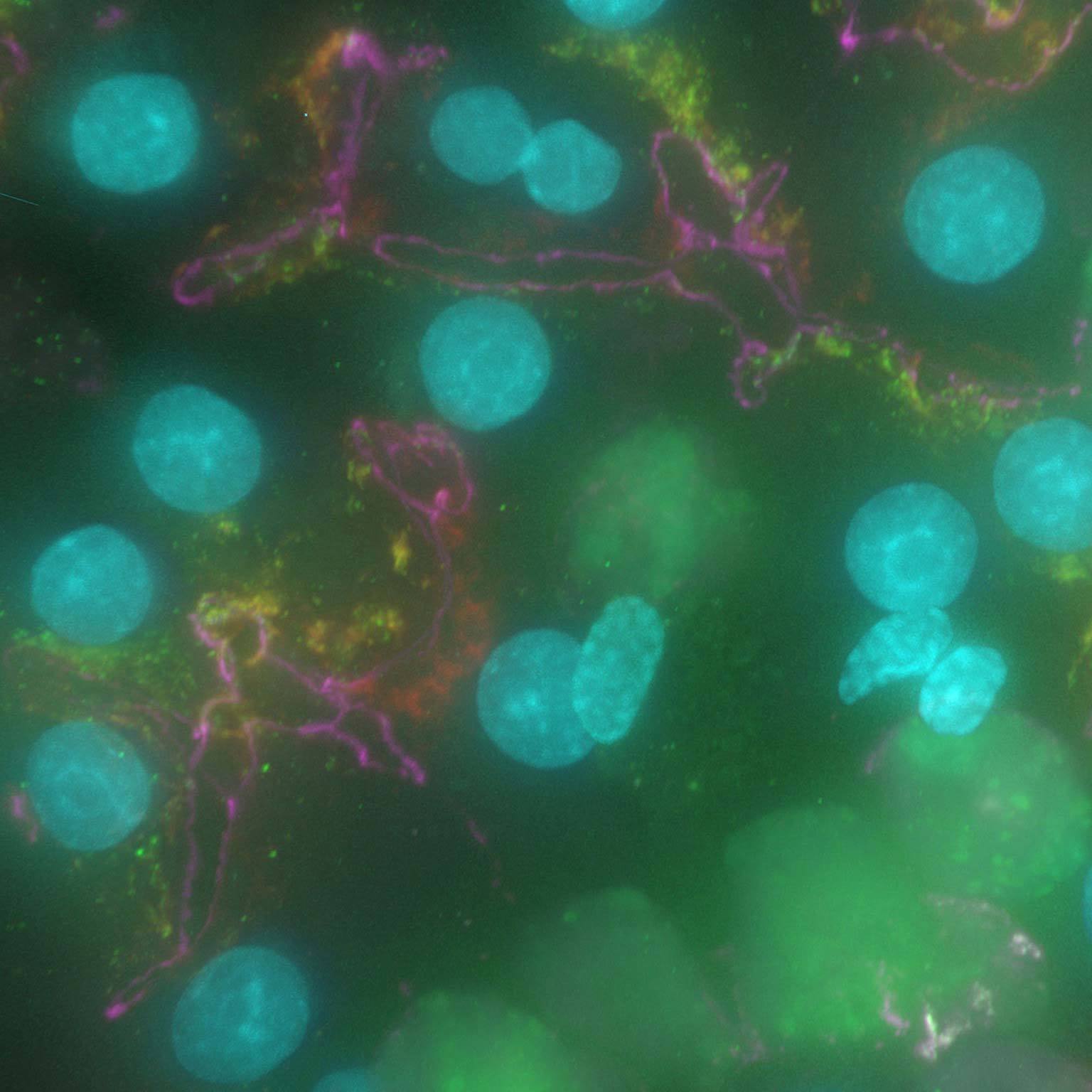
Les données à champ large peuvent être contaminées par la lumière dispersée et floue, mais les outils basés sur l'IA peuvent récupérer des images à contraste élevé en supprimant le bruit et le flou.
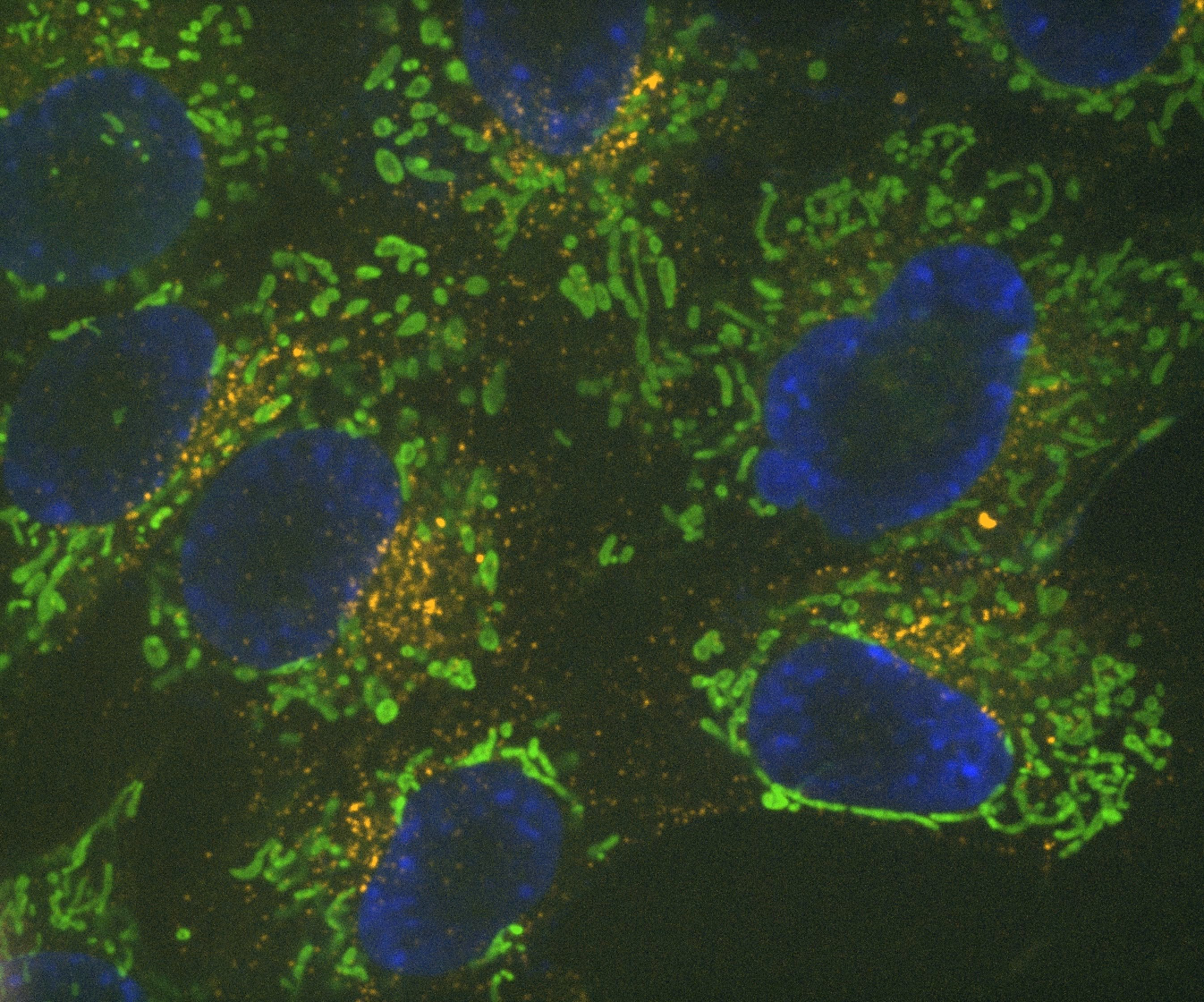
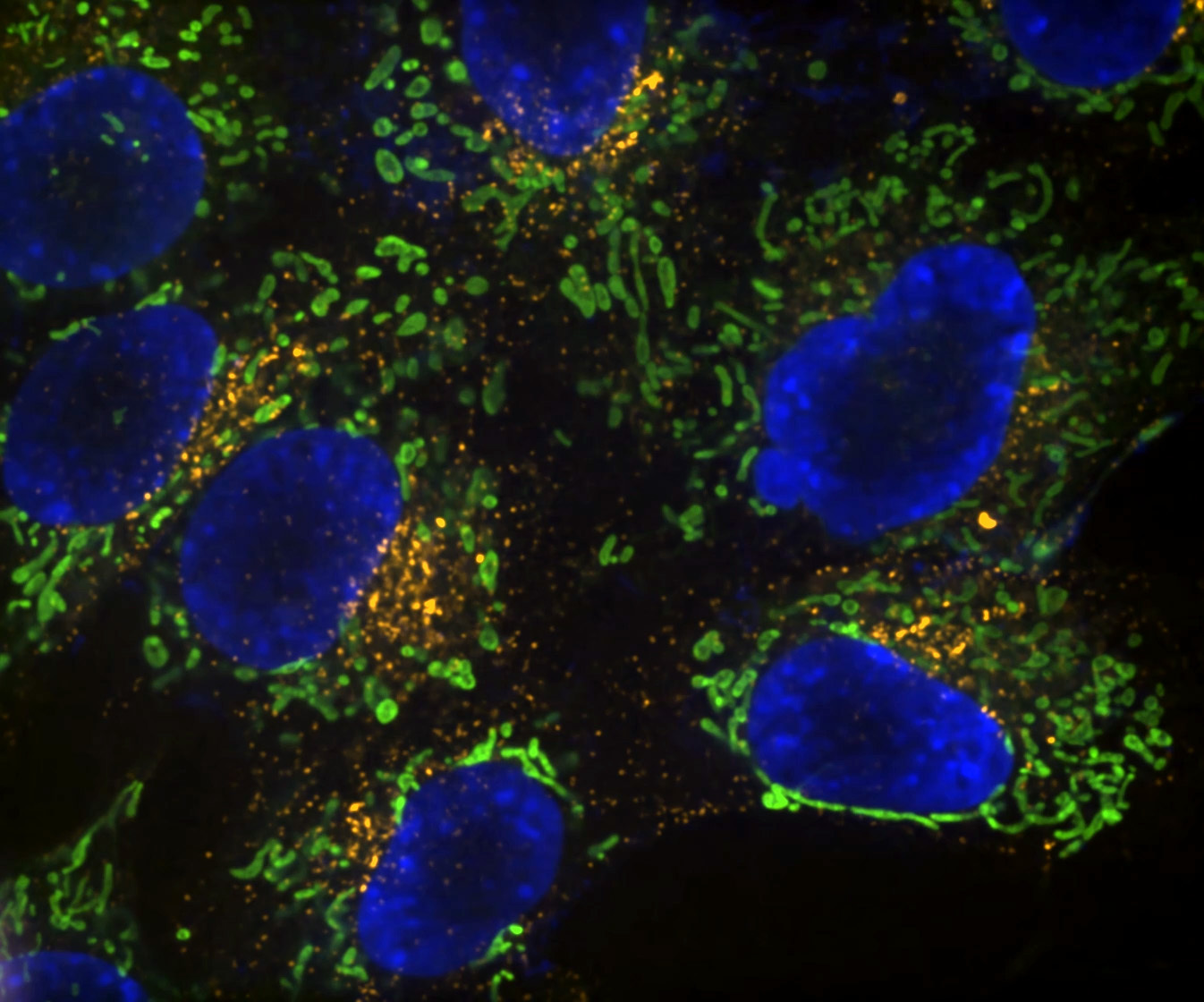
Denoise.ai peut être appliqué pour supprimer la composante de bruit de tir des images tout en laissant la structure sous-jacente et les valeurs d'intensité intactes.
L'avènement des méthodes d'intelligence artificielle (IA) pour la microscopie a ouvert de nouvelles possibilités pour l'imagerie des cellules vivantes avec une dose réduite de photons. Les méthodes basées sur le Deep Learning s'avèrent adaptées aux dosages basés sur des images de spécimens biologiques. Nikon s'engage à développer des solutions logicielles stables basées sur le Deep Learning pour diverses applications - disponibles sous forme de modules NIS.ai pour notre logiciel NIS-Elements.
Clarify.ai permet de supprimer automatiquement le flou de mise au point des images de fluorescence à champ large standard. Ce module est préformé dans notre usine et ne nécessite pas d'ajustement manuel de l'image finale basé sur l'utilisateur, supprimant ainsi la possibilité de subjectivité. Clarify.ai permet ainsi d'effectuer une coupe optique sur des images à champ large à un seul plan acquises à la vitesse maximale du système, ne nécessitant pas de données provenant de plusieurs plans comme avec la déconvolution itérative 3D des données à champ large.
Denoise.ai est un autre module préformé et utilisé pour supprimer le bruit de Poisson (bruit de tir) des images confocales en temps réel. Cela permet des temps d'exposition réduits et est avantageux lorsqu'il est utilisé en conjonction avec des images à balayage résonant acquises à l'aide du microscope confocal AX R, où le bruit de tir est la source prédominante de bruit.
Nikon propose également le module Convert.ai pour prédire les caractéristiques d'image qui sont généralement détectées dans un canal de fluorescence, avec le signal prédit basé sur une image sur fond clair correspondante (par exemple, prédiction des motifs de coloration nucléaire DAPI à partir des données d'image DIC). Cela permet d'éliminer les canaux d'imagerie par fluorescence, en évitant l'éclairage intense exigé par les techniques de fluorescence. Les techniques d'imagerie sur fond clair sont intrinsèquement moins phototoxiques.
Enhance.ai peut être formé pour prédire les détails dans les images à faible rapport signal sur bruit (SNR), améliorant efficacement le SNR et permettant une imagerie avec une dose de photons réduite et un photoblanchiment.
Quelle technique de contraste convient à votre recherche ?
Image en fluorescence sur champ large d'un glomérule rénal de souris dans une coupe de tissu de 16 mm d'épaisseur avant (a) et après (b) déconvolution itérative 3D dans le logiciel NIS-Elements.
Pour les échantillons bidimensionnels relativement plats, tels que les cellules adhérentes cultivées in vitro, l'imagerie par fluorescence à champ large peut être suffisante. Les cas d'utilisation et les types d'échantillons compatibles sont beaucoup plus larges lorsqu'on combine l'imagerie à grand champ avec l'analyse de déconvolution ou le brouillage automatique à l'aide du module logiciel Clarify.ai.
L'imagerie confocale devient nécessaire lors de l'imagerie d'échantillons de plus de 20 μm d'épaisseur, mais est également utile pour l'imagerie à haute résolution d'échantillons même de quelques μm d'épaisseur. Les instruments confocaux à disque rotatif sont rapides et adaptés aux échantillons jusqu'à ~ 50 μm (le CSU-W1 étant capable d'imager plus profondément que les autres modèles en raison d'un plus grand espacement entre les sténopés). Les deux systèmes sont applicables à l'imagerie de différents types de systèmes de culture cellulaire 3D, tels que les organoïdes et les sphéroïdes.
L'imagerie confocale à balayage laser est capable d'imager plus profondément, jusqu'à plusieurs centaines de μm. Le scanner résonnant présenté sur le confocal AX R est capable de fournir une imagerie à fréquence vidéo et est destiné à être combiné avec Denoise.ai pour la suppression du bruit de tir en temps réel. Contrairement aux systèmes à disque rotatif, l'AX R dispose d'un sténopé réglable en continu pour optimiser la section optique et la résolution avec n'importe quel objectif compatible.
L'imagerie par fluorescence à réflexion interne totale (TIRF) est une technique de sectionnement optique qui permet l'observation exclusive des caractéristiques cellulaires se produisant à quelques centaines de nm de l'interface cellule-lamelle. Cela fournit une amélioration du SNR, permettant l'utilisation d'une puissance laser inférieure pour protéger la santé des cellules et/ou maximiser la vitesse d'imagerie. Les objectifs de la série CFI Apochromat TIRF de Nikon présentent également une NA très élevée de 1,49.e
Les techniques de microscopie à super-résolution sont utilisées lorsqu'une résolution optique au-delà de la limite de diffraction est spécifiquement requise pour résoudre les détails nécessaires. La microscopie à super-résolution de cellules vivantes a généralement été difficile en raison des compromis exigés de ces techniques variées pour améliorer la résolution. Le Yokogawa CSU-W1 SoRa est un système de super-résolution mis en œuvre dans le contexte d'un système confocal à disque rotatif, permettant une imagerie à des vitesses correspondant au CSU-W1 seul (en supposant un signal suffisant).
Alors que les techniques d'imagerie en fluorescence sont puissantes, permettant la détection multiplexée de cibles moléculaires distinctes, les techniques d'imagerie sur fond clair telles que le contraste de phase et le contraste d’interférencedifférentielle (DIC) fournissent des images cellulaires détaillées avec une dose de photons nettement inférieure. Bien que ces techniques puissent manquer de la spécificité moléculaire requise, il est recommandé d'acquérir occasionnellement des images sur fond clair afin d'aider à évaluer la santé des cellules au cours de l'expérience.
Glossaire
- Champ de vision
- Le champ de vision du système, également appelé numéro de champ, est le diamètre de la zone d'imagerie à un grossissement nominal de 1X.
- Limite de profondeur d'imagerie relative
- Cela indique la plage de profondeur Z (axiale) approximative dans laquelle le système indiqué peut fournir des images avec une qualité de sectionnement optique et un rapport signal/bruit suffisants. Cette valeur peut être assez variable et dépend fortement des propriétés optiques de l'échantillon et du récipient, ainsi que du marquage.
- Modalités d'imagerie prises en charge
- Il s'agit des diverses techniques d'imagerie par microscopie fournies par chaque système. Notez que presque toutes les modalités d'imagerie prises en charge par le microscope inversé ECLIPSE Ti2-E sont toujours accessibles lorsqu'il est utilisé comme base pour l'un des autres systèmes répertoriés dans ce tableau.
- Prend en charge l'imagerie de débit vidéo
- Le « débit vidéo » est traditionnellement défini comme environ 30 images par seconde (FPS). Le taux d'imagerie optimal dépend de l'application exacte et peut être plus rapide ou plus lent que 30 FPS. Les caméras EM-CCD peuvent généralement imager jusqu'à 60 FPS (plein cadre) et les caméras sCMOS jusqu'à 40-100 FPS (plein cadre).
- Supports de microscope compatibles
- Il s'agit des modèles de supports de microscope Nikon compatibles avec chaque système.
- Accueil
- Applications
- Sciences de la vie
- Imagerie de cellules vivantes