Électrophysiologie

L'électrophysiologie est l'étude des propriétés électriques des spécimens biologiques. Bien que ce terme puisse faire référence aux méthodes classiques d'enregistrement électrique à l'échelle des tissus/organes utilisées en milieu clinique (par exemple, l'électrocardiographie), ainsi qu'aux méthodes d'enregistrement au niveau cellulaire/subcellulaire généralement effectuées en conjonction avec un microscope optique dans un laboratoire de recherche et d’intérêt ici. L'enregistrement en patch-clamp continue de servir de norme pour l'enregistrement de l'activité électrique dans des cellules neuronales ou musculaires uniques (ou des canaux ioniques uniques). L'enregistrement peut être effectué dans une variété de systèmes modèles, y compris les cultures cellulaires in vitro, les tissus excisés et in vivo.
Les méthodes d'enregistrement enpatch-clamp nécessitent l'aspiration d'un “patch“ de la membrane cellulaire à l'aide d'une pipette en verre d'une épaisseur de micromètres (positionnée à l'aide d'un système de micromanipulation). Un fin fil d'argent à l'intérieur de la pipette permet l'enregistrement électrique. Les méthodes de patch sur cellule entière et de patch perforé permettent en outre d'ajouter des colorants fluorescents (par exemple, des indicateurs de tension, de calcium) pour l'observation microscopique, en plus d'autres agents expérimentaux.
Produits pour l'électrophysiologie

Le microscope droit ECLIPSE FN1 est la solution de microscope de base de Nikon pour les applications d'électrophysiologie. Ce microscope est doté d'un cadre mince en forme de I qui donne la priorité à l'accès à l'échantillon, offrant de l'espace pour le positionnement des micromanipulateurs et d'autres équipements. Le porte-objectif coulissant avant/arrière à 2 positions permet de changer d'objectifs, l'objectif est rétracté de 15 mm lors du changement de position afin d'éviter de perturber l'échantillon et l'équipement de micromanipulation.
Le FN1 est compatible avec une gamme de solutions confocales et multiphotoniques pour une imagerie plus profonde. Les microscopes confocaux à disque rotatif de la série CSU de Yokogawa permettent une coupe optique rapide dans les cellules vivantes et les tranches de tissu. Les microscopes confocaux Nikon AX / AX R sont des instruments à balayage ponctuel, qui permettent une imagerie plus profonde qu'avec un disque rotatif. L'AX R est le modèle à balayage résonant, et capable d'imager à une vitesse allant jusqu'à 720 images par seconde (FPS ; mode de balayage 2048 x 16 bandes), permettant d'imager la dynamique du calcium et d'autres dynamiques similaires rapides.
●: Inclus, ⚬: Optionnel
| ECLIPSE FN1 Microscope droit (champ large uniquement) |
Yokogawa CSU-X1 Confocal à disque rotatif* |
Yokogawa CSU-W1 Confocal à disque rotatif* | AX / AX R Système confocal* |
A1 MP+ / A1R HD MP+ Système multiphotonique* |
|
|---|---|---|---|---|---|
| Champ de vision | Diagonale de 25 mm (large champ ; circulaire) | 10 x 7 mm (confocal; rectangulaire) | 17 x 16 mm (confocal; rectangulaire) | Diagonale de 25 mm (confocal; carré) | Diagonale de 18 mm (multiphoton; carré) |
| Agrandissement du zoom | 0,35X, 2,0X, 4X (champ large ; avec double port FN-DP et changeur de grossissement) 1,0X, 1,25X, 1,5X, 2,0X (champ large ; avec tourelle de changement de grossissement FN-MT) | 1 – 1000X (confocal ; zoom de balayage variable en continu) | 1 – 1000X (multiphoton ; zoom de balayage variable en continu) | ||
| Limite de profondeur d'imagerie relative | ~ 5 μm ~ 15 – 25 μm (avec déconvolution) |
~ 50 μm | ~ 50 – 100 μm | ~ 100 – 500 μm | ~ 1.4 mm (avec excitation à 1300 nm) |
| Techniques de contraste compatibles | ECLIPSE FN1 | CSU-X1* | CSU-W1* | AX / AX R* | A1 MP+ / A1R HD MP+* |
| Champ lumineux | yes | no | no | no | no |
| Confocal - Balayage laser | no | no | no | yes | yes |
| Confocal - Disque tournant | no | yes | yes | no | no |
| Contraste d'interférence différentielle (DIC) | yes | no | no | no | no |
| DIC infrarouge (IR-DIC) | yes | no | no | no | no |
| Multiphoton - Balayage laser | no | no | no | no | yes |
| Éclairage oblique | yes | no | no | no | no |
| Lumière polarisée simple | yes | no | no | no | no |
| Fluorescence sur champ large | yes | no | no | no | no |
*La compatibilité d'un système confocal et multiphoton dans ce tableau avec des techniques de contraste supplémentaires dépend du statif de microscope auquel le système est fixé. Par exemple, configurer un système confocal AX / AX R sur un microscope ECLIPSE FN1 permettrait d'utiliser des techniques de contraste compatibles avec le FN1.
Discussion sur l'électrophysiologie

Image IR-DIC d'un neurone en patch-clamp dans un tissu cérébral explanté acquise à l'aide d'un microscope droit FN1.
Techniques de contraste à utiliser dans les expériences d'électrophysiologie
Bien que le marquage en fluorescence des échantillons utilisés dans les expériences d'électrophysiologie soit assez courant, il n'est pas nécessaire pour l'enregistrement en patch-clamp. Ainsi, une technique d'imagerie sans marquage est généralement utilisée pour visualiser l'échantillon. Cela peut être difficile car les échantillons sont souvent assez épais (par exemple, des tranches de cerveau de plusieurs centaines de μm d'épaisseur), diffusant la lumière et limitant la profondeur avec laquelle une observation suffisamment détaillée peut être effectuée.
Alors que les techniques sans marquage telles que la microscopie sur fond clair et en contraste de phase peuvent être utiles pour des échantillons plus minces, tels que les cultures de cellules adhérentes, elles ne sont pas adaptées à l'imagerie dans des coupes de tissus épais ou in vivo. Le contraste interférentiel différentiel (DIC) est une option en raison de sa capacité de sectionnement optique, permettant une imagerie plus profonde tout en maintenant une résolution élevée (le DIC utilise la pleine ouverture numérique de l'objectif).
Malheureusement, le DIC seul est souvent insuffisant. Pour cette raison, Nikon propose un DIC proche infrarouge (IR-DIC), qui utilise un éclairage proche infrarouge (NIR) et des composants optiques compatibles. La lumière NIR pénètre plus loin dans les échantillons de diffusion grâce aux longueurs d'onde plus longues de la lumière NIR par rapport à la lumière visible, ce qui permet d'identifier les neurones individuels à des profondeurs où la lumière visible DIC échoue.
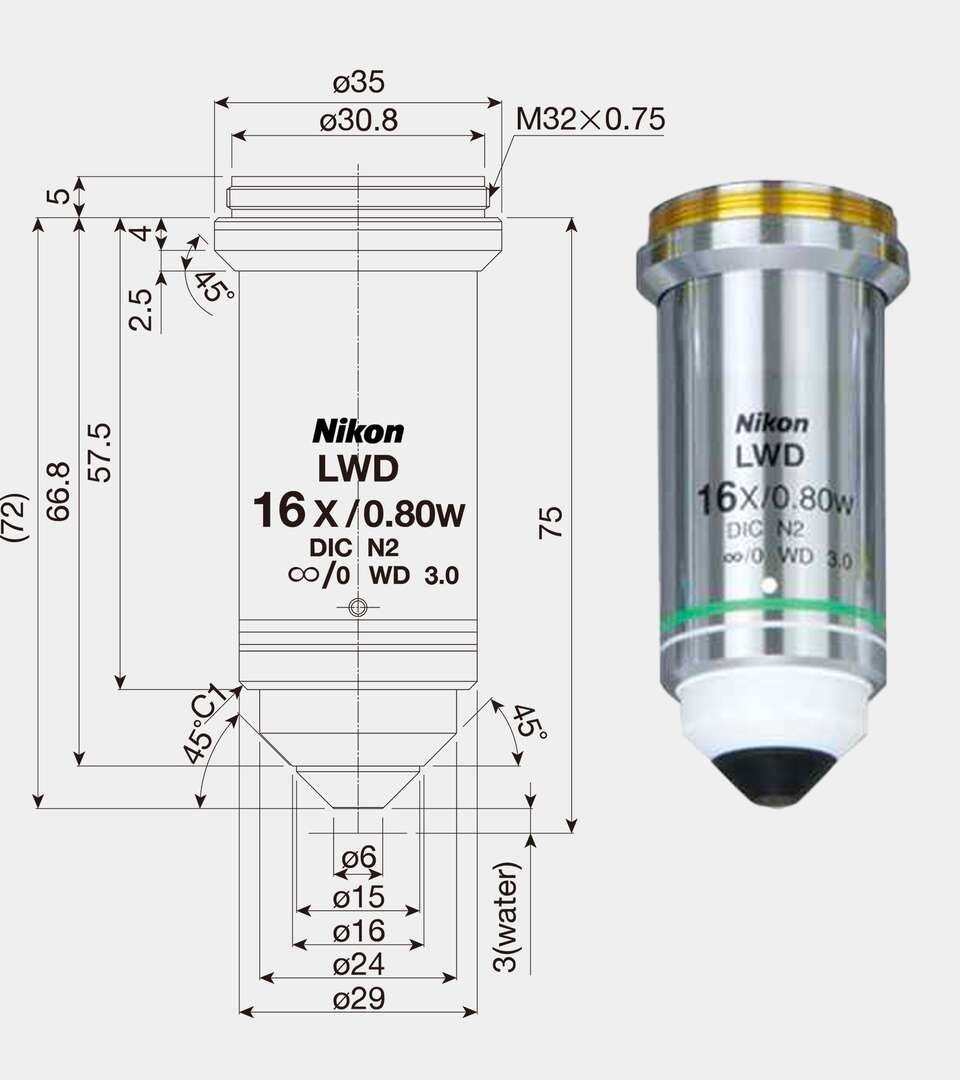
Objectifs pour les expériences d'électrophysiologie
Les microscopes sont généralement configurés avec des objectifs plongeant dans l'eau pour les expériences d'électrophysiologie - où la pointe de la lentille est directement immergée dans le milieu d'échantillon aqueux (sans lamelle). Les objectifs d'immersion dans l'eau pour l'électrophysiologie ont souvent des pointes constituées d'un matériau chimiquement inerte et électriquement isolant, tel que la céramique. Le facteur de forme de la lentille d'objectif est également important, la pointe de l'objectif doit avoir un angle d'approche raide vers la pointe afin de fournir un accès maximal à l'échantillon pour les micromanipulateurs.
Les objectifs de la série Nikon CFI60 Water Dipping présentent des degrés élevés de correction d'aberration et de transmission dans le NIR, ce qui les rend adaptés à la recherche en électrophysiologie, en particulier en combinaison avec l'imagerie IR-DIC ou multiphotonique. Tous les objectifs CFI60 Water Dipping sont compatibles avec IR-DIC, les objectifs NIR 40X W et NIR 60X W bénéficiant en outre de leur transmission NIR améliorée. Le CFI Plan 100XC W dispose d'un collier de correction pour la correction des aberrations sphériques.
Les objectifs Nikon CFI75 Water Dipping Series comprennent des objectifs 16X et 25X à immersion dans l'eau, et sont physiquement plus grands que les objectifs CFI60 de Nikon, avec une taille de filetage de M32 et une distance parfocale de 75 mm afin de s'adapter aux grandes optiques nécessaires pour collecter la lumière à un angle suffisamment large pour obtenir une ouverture numérique élevée (NA) avec une distance de travail plus longue. Le CFI75 LWD 16X W est un choix populaire en tant que « solution à objectif unique », avec des grossissements de 5,6X, 32X et 64X accessibles à l'aide du double port FN-DP et du changeur de grossissement. Le CFI75 Apochromat 25XC W 1300 est l'un des objectifs les plus brillants fabriqués par Nikon et offre une transmission élevée et une correction des aberrations jusqu'à 1300 nm. Tous les objectifs CFI75 Water Dipping sont également compatibles avec IR-DIC.
Configuration du microscope pour l'électrophysiologie et l'optogénétique
La stimulation optogénétique des cellules exprimant des actionneurs optogénétiques pour diverses fonctions, telles que le channelrhodopsine-2 (ChR2) du canal ionique photo-dépendant, est une méthode populaire pour une variété d'applications expérimentales. La stimulation électrique optogénétique des cellules neurales et musculaires est complétée par un enregistrement en patch-clamp en tant que lecture. Cette méthode permet d'évaluer directement les connexions fonctionnelles locales et à longue portée de différents neurones. La stimulation optogénétique est généralement réalisée à l'aide d'un éclairage à motifs provenant d'un dispositif de photostimulation dédié.
Le microscope ECLIPSE FN1 peut être configuré avec un appareil de photostimulation à point unique réglable manuellement ou un appareil à micromiroir numérique (DMD). Les DMD permettent l'application de motifs d'éclairage arbitraires avec une structure limitée proche de la diffraction. Cela permet un ciblage précis de la stimulation cellulaire à sous-cellulaire avec des modèles programmables par l'utilisateur et des taux de permutation allant jusqu'à 4000 Hz.
Glossaire
- Agrandissement du zoom
- Le grossissement du zoom dans un microscope à champ large est généralement fourni optiquement, par exemple avec un accessoire de changement de grossissement fournissant un nombre prédéfini d'options, comme avec le microscope FN1. Les systèmes confocaux et multiphotons à balayage laser reposent généralement sur le zoom de balayage, où le zoom optique est simulé en balayant uniquement une petite région tout en conservant une résolution de pixels élevée.
- Champ de vision
- Le champ de vision du système, également appelé numéro de champ, est le diamètre de la zone d'imagerie à un grossissement nominal de 1X.
- Limite de profondeur d'imagerie relative
- Cela indique la plage de profondeur Z (axiale) approximative dans laquelle le système indiqué peut fournir des images avec une qualité de sectionnement optique et un rapport signal/bruit suffisants. Cette valeur peut être assez variable et dépend fortement des propriétés optiques de l'échantillon et du récipient, ainsi que du marquage.
- Techniques de contraste compatibles
- En règle générale, les systèmes de microscope pour l'électrophysiologie sont capables d'au moins une technique de lumière transmise pour prendre en charge l'imagerie sans marquage, telle que l'IR-DIC. Une modalité d'imagerie par fluorescence (champ large, confocal ou multiphoton) peut également être nécessaire pour différentes expériences.