- de Change Region
- Global Site
- Home
- Anwendungen
- Biowissenschaften
- Elektrophysiologie
Elektrophysiologie

In der Elektrophysiologie untersucht man elektrochemische Signalübertragungen in biologischen Proben. Dieses Forschungsgebiet umfasst elektrische Aufzeichnungsverfahren auf Gewebe-/Organ-Größenordnung (z. B. die klinische Elektrokardiographie), sowie Ableitungsverfahren auf zellulärer/subzellulärer Ebene, die typischerweise in Verbindung mit einem optischen Mikroskop in einem Forschungslabor durchgeführt werden und dort von Interesse sind. Die Patch-Clamp-Technik hat sich als Standard zur Aufzeichnung der elektrischen Aktivität in einzelnen Nerven- oder Muskelzellen, oder einzelnen Ionenkanälen in deren Zellmembran etabliert. Elektrophysiologische Experimente können an einer Vielzahl von Modellsystemen durchgeführt werden, einschließlich in-vitro-Zellkulturen, exzidiertem Gewebe und an Ganztieren.
Bei der Patch-Clamp-Technik wird ein winziges Areal der Zellmembran („Patch“) mit einer Glaspipette angesaugt, deren Spitze im µm-Bereich ist und die mit einem Mikromanipulationssystem positioniert wird. Ein dünner Silberdraht in der Pipette ermöglicht die elektrische Aufzeichnung. Whole-Cell-Patch- und Perforated-Patch-Methoden ermöglichen die Zugabe von fluoreszierenden Farbstoffen, um mikroskopisch deren Verteilung und Dynamik zu beobachten (z. B. Indikatoren für elektrische Spannung, freie Calcium-Ionen).
Produkte für Elektrophysiologie
Das aufrechte Mikroskop ECLIPSE FN1 ist die zentrale Mikroskop-Lösung von Nikon für elektrophysiologische Anwendungen. Dieses Mikroskop hat ein schlankes, I-förmiges Stativ, das den Zugang zur Probe priorisiert und Platz für die Positionierung von Mikromanipulatoren, Badkammern und anderem speziellen Zubehör bietet. Der nach vorn/hinten verschiebbare Objektivhalter mit 2 Positionen ermöglicht das Wechseln der Objektive, wobei das längere vor dem Wechsel um 15 mm angehoben wird, um Störungen im mikroskopischen Arbeitsfeld mit Pipetten-Spitzen etc. zu vermeiden.
Das FN1 ist kompatibel mit einer Reihe von konfokalen und Multiphotonen-Systemen für das Imaging in weiter tieferen Zell- oder Gewebeschichten. Die konfokalen Spinning-Disk-Systeme der CSU-Serie von Yokogawa ermöglichen das schnelle Aufzeichnen optischer Schnitte in lebenden Zellen und Gewebeschnitten. Die konfokalen Nikon-Mikroskope AX / AX R sind Punkt-Scanner, mit denen man optische Schnitte aus tieferen Ebenen in Gewebeproben erzeugen kann als mit Spinning-Disk-Mikroskopen. Das AX R hat den Resonanz-Scanner und erreicht Bildraten von bis zu 720 Bildern pro Sekunde (fps; z.B. im Band-Scan-Modus 2048 x 16), wodurch beispielsweise Verteilungen freier Kalzium-Ionen und andere ähnlich schnelle Prozesse in lebenden Systemen abgebildet werden können.
●: enthalten, ⚬: option
| ECLIPSE FN1 Aufrechtes Mikroskop (Weitfeld) |
Yokogawa CSU-X1 konfokal Spinning Disk* |
Yokogawa CSU-W1 konfokal Spinning Disk* | AX / AX R konfokal Punktscanner* |
A1 MP+ / A1R HD MP+ Multiphotonen-System* |
|
|---|---|---|---|---|---|
| Sehfeld | 25 mm Diagonale (Weitfeld; kreisförmig) |
10 x 7 mm (konfokal; rechteckig) |
17 x 16 mm (konfokal; rechteckig) |
25 mm Diagonale (konfokal; quadratisch) |
18 mm Diagonale (Multiphoton; quadratisch) |
| Zoom-Vergrößerung | 0,35-fach, 2,0-fach, 4-fach (Weitfeld; mit FN-DP Doppelausgang und Vergrößerungswechsler); 1,0-fach, 1,25-fach, 1,5-fach, 2,0-fach (Weitfeld; mit FN-MT-Vergrößerungswechsler) | 1 – 1000X (konfokal; stufenloser Scan-Zoom) | 1 – 1000X (Multiphoton; stufenloser Scan-Zoom) | ||
| Grenzbereich für das Imaging in tieferen Schichten | ~ 5 μm, ~ 15 – 25 μm (mit Dekonvolution) | ~ 50 μm | ~ 50 – 100 μm | ~ 100 – 500 μm | ~ 1,4 mm (bei 1300 nm Anregungswellenlänge) |
| Mikroskopiertechniken | ECLIPSE FN1 | CSU-X1* | CSU-W1* | AX / AX R* | A1 MP+ / A1R HD MP+* |
| Hellfeld | yes | no | no | no | no |
| Konfokal - Punktscanner | no | no | no | yes | yes |
| Konfokal – Spinning Disk | no | ja | ja | no | no |
| Differentieller Interferenzkontrast (DIC) | yes | no | no | no | no |
| Infrarot-DIC (IR-DIC) | yes | no | no | no | no |
| Multiphoton - Punktscanner | no | no | no | no | yes |
| Schräge Beleuchtung | yes | no | no | no | no |
| Einfache Polarisation | yes | no | no | no | no |
| Weitfeld-Fluoreszenz | yes | no | no | no | no |
*Die Kompatibilität eines Konfokal- und Multiphotonen-Systems in dieser Tabelle mit zusätzlichen Kontrastierungstechniken hängt vom Mikroskop-Stativ ab, das im System integriert ist. Beispielsweise würde die Konfiguration eines konfokalen AX / AX R-Systems mit einem ECLIPSE FN1-Mikroskop alle Kontrastierungstechniken ermöglichen, die mit dem FN1 realisierbar sind.
Zugehörige Literatur
Diskussion Elektrophysiologie
Kontrastierungstechniken bei Experimenten in der Elektrophysiologie
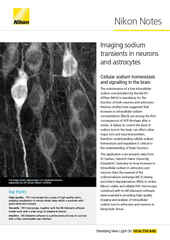
IR-DIC-Bild von Neuronen mit Patch-Pipette in exzidiertem Hirngewebe, aufgenommen mit dem aufrechten Mikroskop FN1.
Fluoreszenztechniken sind bei elektrophysiologischen Experimenten weit verbreitet, für die Durchführung der eigentlichen Patch-Clamp-Technik jedoch nicht unbedingt erforderlich. Es kommen hierfür Kontrastierungstechniken zum Einsatz, die eine möglichst gute morphologische Darstellung der Probe ermöglichen. Dies kann optisch ziemlich herausfordernd sein, da die Proben oft vergleichsweise dick sind (z. B. Hirnschnitte einige hundert μm). Darin wird Licht relativ stark gestreut, wodurch die Tiefe limitiert wird, in die man in die vitalen Proben bei guter Abbildungsqualität hineinfokussieren kann.
Hellfeld- und Phasenkontrastmikroskopie eignen sich besonders für dünnere Proben wie z.B. adhärente Zellkulturen, sind jedoch bei dickeren Proben, beispielsweise nativen Hirnschnitten eher ungünstig. Der differentielle Interferenzkontrast (DIC) vereint hohe Auflösung bei gutem Kontrast mit der Fähigkeit, in dickeren Proben optische Schnitte darzustellen. Das liegt daran, dass beim DIC die volle numerische Apertur des Objektivs genutzt werden kann.
Leider reicht der normale DIC allein oft nicht aus. Aus diesem Grund bietet Nikon den Nahinfrarot-DIC (IR-DIC) an, bei dem Nahinfrarot (NIR)-Beleuchtung zusammen mit kompatiblen optischen Komponenten verwendet wird. Dank der längeren Wellenlänge von NIR-Licht im Vergleich zu sichtbarem Licht durchdringt NIR-Licht dickere, streuende Proben besser und tiefer, wodurch es möglich wird, einzelne Neuronen in tieferen Schichten dickerer Proben morphologisch gut darzustellen, in denen DIC bei sichtbarem Licht versagt.
Objektive für elektrophysiologische Experimente
In Setups für elektrophysiologische Experimente mit aufrechten Mikroskopen werden üblicherweise Wasser-Objektive (ohne Deckglas) eingesetzt, wobei die Objektivspitze direkt in das wässrige Probenmedium eintaucht. Diese Wassertauchobjektive für die Elektrophysiologie haben häufig Spitzen aus einem chemisch inerten und elektrisch isolierenden Material, wie beispielsweise Keramik. Die Form der Objektive ist ebenfalls wichtig, die Objektivspitze sollte einen möglichst steilen Anstellwinkel erlauben, um maximalen Zugang von Patch-Pipetten, Mikrokapillaren etc. über Mikromanipulatoren zur Probe zu bieten.
Die Nikon Objektive-Reihe CFI60 Wassereintauchimmersion verfügen über eine exzellente Aberrationskorrektur und Transmission im NIR, wodurch sie sich in der elektrophysiologischen Forschung besonders auch für die IR-DIC- und Multiphotonen- Mikroskopie eignen. Alle CFI60 Wassertauch-Objektive sind kompatibel mit IR-DIC, wobei die Objektive NIR 40X W und NIR 60X W zusätzlich von ihrer verbesserten NIR-Transmission profitieren. Das Objektiv CFI Plan 100XC W verfügt über einen Einstellring zur Korrektur der sphärischen Aberration.
Die Nikon Objektiv-Reihe CFI75 Wassereintauchimmersion umfasst ein 16X- und ein 25X-Wassertauch-Objektiv. Beide sind länger als die CFI60-Objektive von Nikon, und haben eine Gewindegröße von M32 sowie eine Abgleichlänge von 75 mm. Dies erlaubt die Aufnahme größer dimensionierter Optik, die zum Sammeln von möglichst viel Licht erforderlich ist, und bemessen genug, um eine hohe numerische Apertur (NA) zusammen mit einem längeren Arbeitsabstand zu erreichen. Das Objektiv CFI75 LWD 16X W ist eine beliebte Wahl als „Einzelobjektivlösung“ mit den Vergrößerungen 5,6-, 32- und 64-fach, die mit dem FN-DP-Modul mit Doppel-Kameraausgang und Vergrößerungswechsler realisierbar sind. Das CFI75 Apochromat 25XC W 1300 ist eines der lichtstärksten Objektive, die Nikon herstellt, und verfügt über eine hohe Transmission und exzellente Aberrationskorrektur bis 1300 nm. Alle CFI75 Wassereintauch- Objektive sind auch mit IR-DIC kompatibel.
Mikroskop-Konfiguration für Elektrophysiologie und Optogenetik
Die optogenetische Stimulation bzw. Inaktivierung von Zellen mit exprimierten lichtgesteuerten Ionenkanälen für verschiedene Funktionen, wie z. B. dem depolarisierenden Kationenkanal Channelrhodopsin-2 (ChR2), ist eine beliebte Methode für eine Vielzahl von Experimenten, insbesondere in der Neurobiologie. Die optogenetisch lichtgesteuerte Stimulation von Nerven- und Muskelzellen wird häufig durch Patch-Clamp-Aufzeichnung ergänzt. Mit dieser Methode können die lokalen und weiträumigen funktionellen Verbindungen verschiedener Neuronen direkt ausgewertet werden. Die optogenetische Stimulation wird oft mit Fotostimulationsilluminatoren durchgeführt, die ein ortsgenaues Beleuchtungsmuster erzeugen können.
Das Mikroskop ECLIPSE FN1 kann mit einem manuell einstellbaren Einzelpunkt-Fotostimulationsilluminator oder einem Illuminator mit digital ansteuerbaren Mikrospiegeln (DMD) konfiguriert werden. Ein DMD-Illuminator (Digital Micro-Mirror Device) lässt beliebige Beleuchtungsmuster mit nahezu beugungsbegrenzter Strukturierung gestalten. Dadurch wird ein präzises und ortsgenaues Definieren der Stimulationsarreale auf zellulärer und subzellulärer Ebene mit benutzerprogrammierbaren Mustern und Schaltraten von bis zu 4000 Hz möglich.
Glossar
- Grenzbereich für das Imaging in tieferen Schichten
- Das ist die ungefähre Distanz entlang der Z-Achse, über die das jeweilige System mit dem Objektiv in tiefere Schichten der Probe „Hineinfokussieren“ kann, um noch optische Schnitt-Bilder mit angemessener Qualität und ausreichendem Signal-Rausch-Verhältnis zu liefern. Dieser Wert kann sehr variabel sein und hängt stark von den optischen Eigenschaften der Probe, der Art der Probenkammer sowie der (Fluoreszenz-) Färbung ab.
- Mikroskopiertechniken
- Typischerweise können Mikroskop-Systeme für die Elektrophysiologie mindestens eine Durchlichttechnik, um die Morphologie der Probe darzustellen, beispielsweise IR-DIC. Mindestens eine fluoreszenzmikroskopische Technik (Weitfeld, konfokal oder Multiphoton) kann häufig für verschiedene Experimente erforderlich sein.
- Sehfeld
- Das Sehfeld eines Mikroskop-Systems, auch mit Sehfeldzahl bezeichnet ist Durchmesser/Diagonale (in mm) des reellen Zwischenbildes („imaging area“) bei einer nominalen Vergrößerung von 1x.
- Zoom-Vergrößerung
- Die Zoom- (auch Nach-) Vergrößerung in einem Weitfeld-Mikroskop wird typischerweise optisch mit Linsensystemen erzeugt. Mit dem optionalen Vergrößerungswechsler-Modul für das Mikroskop FN1 kann man z.B. aus einer festen Anzahl von Nachvergrößerungsstufen eine gewünschte in den Strahlengang schalten. Konfokale und Multiphotonen-Systeme mit Punkt-Scanner beruhen normalerweise auf einem Scan-Zoom, bei dem ein optischer Zoom simuliert wird, indem ein kleinerer Sehfeld-Bereich unter Beibehaltung der Pixelauflösung abgescannt und (z.B. auf dem Monitor) dargestellt wird.
- Home
- Anwendungen
- Biowissenschaften
- Elektrophysiologie