- it Change Region
- Global Site
- Casa
- Applicazioni
- Scienze della vita
- Imaging su scala nanometrica
Imaging su scala nanometrica
Per centinaia di anni la risoluzione della microscopia ottica è stata fondamentalmente limitata dalla diffrazione, con ~200 nanometri (nm) considerati il limite approssimativo in XY. Questo può essere sufficiente per osservare singole cellule e molte caratteristiche subcellulari, ma è insufficiente per risolvere dettagli fini nella scala inferiore agli organelli e singole biomolecole, che spesso hanno dimensioni nel singolo nm.
La storia recente ha visto l'invenzione di numerosi metodi di imaging ottico a “super-risoluzione”, sfruttando diverse strategie per aggirare il limite imposto dalla diffrazione. L'importanza della super risoluzione è stata riconosciuta con il Premio Nobel per la Chimica 2014 e ha già contribuito a diverse scoperte, come la struttura dello scaffold periodico assonale.
Prodotti per l'imaging su scala nanometrica
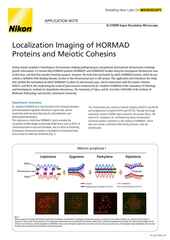
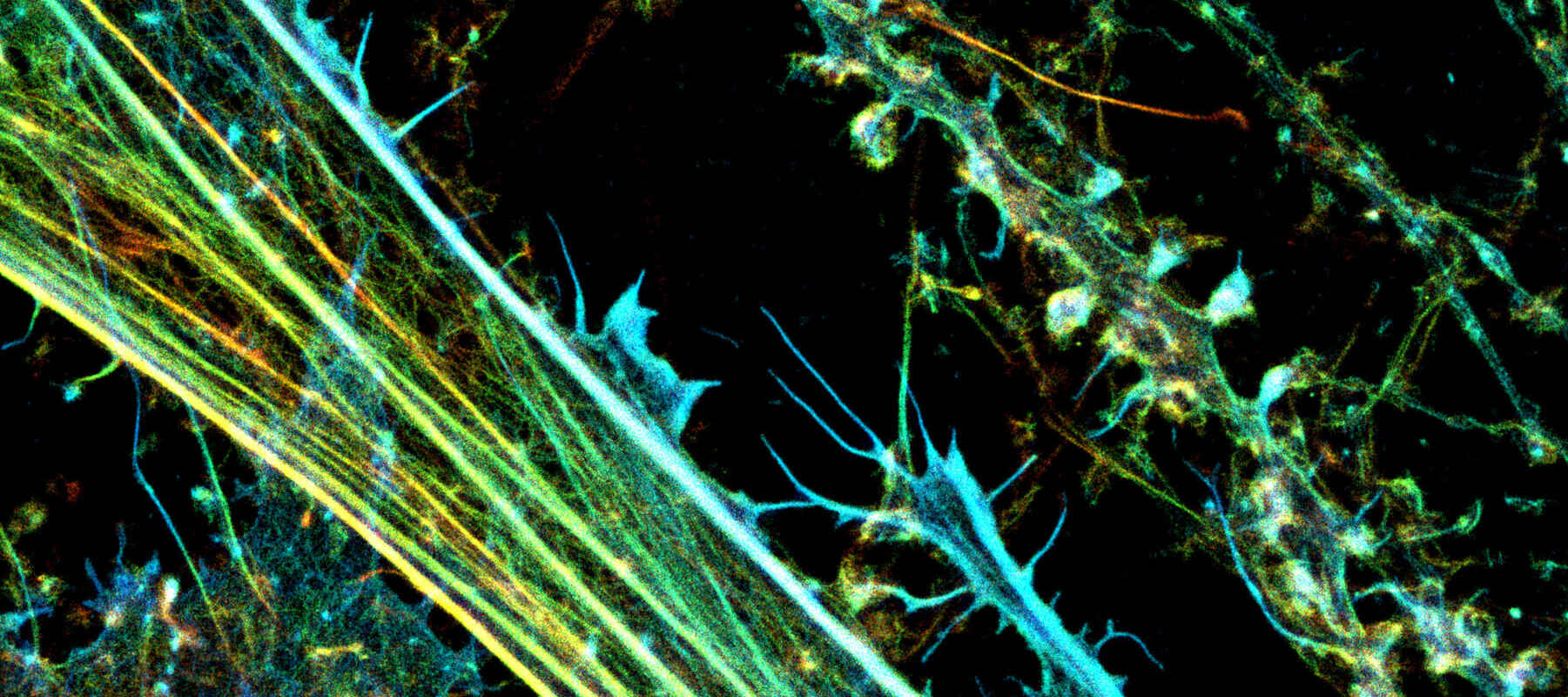
Immagine 3D-STORM di una coltura neuronale con actina marcata in modo fluorescente (codificata a colori per la profondità), acquisita utilizzando un sistema Nikon N-STORM dal Prof. Christophe Leterrier (CR1 CNRS).
Il sistema di microscopio a super risoluzione N-STORM Nikon fornisce la più alta risoluzione dei sistemi offerti da Nikon, circa un ordine di grandezza maggiore rispetto all'epifluorescenza a campo largo in XYZ. L'N-STORM è configurato sul microscopio invertito Ti2-E, che fornisce un'elevata stabilità grazie al sistema di blocco della messa a fuoco Perfect Focus System 4 (PFS4), utilizzato anche per la traslazione assiale fine per la nostra modalità di imaging STORM con impilamento Z, consentendo l'immagine di volumi fino a ~ 5 µm di spessore. L'imaging a fluorescenza a riflessione interna (TIRF) convenzionale è anche possibile utilizzando N-STORM.
Il sistema di microscopio a super risoluzione N-SIM S utilizza un modulatore di luce spaziale per realizzare una rapida commutazione dei modelli di interferenza, fornendo un aumento di velocità sia per modalità a 9 immagini (2D-SIM, TIRF-SIM) che a 15 immagini (3D-SIM ). La SIM a 9 immagini può essere eseguita a velocità fino a 15 fotogrammi al secondo (FPS), compatibile con molte applicazioni di imaging di cellule vive. TIRF-SIM fornisce un ulteriore aumento della risoluzione in (XY), insieme al sezionamento ottico della microscopia TIRF. Il sistema di microscopio a super risoluzione N-SIM E è un modello SIM più conveniente per l'imaging 3D-SIM e fornisce lo stesso miglioramento della risoluzione dell'N-SIM S.
Il Yokogawa CSU-W1 SoRa Super-Resolution Spinning Disk Confocal System è uno strumento confocale a disco rotante che integra un disco con microlenti a emissione per realizzare la super risoluzione mediante la riassegnazione dei pixel ottici. Poiché CSU-W1 SoRa utilizza un design a disco rotante, l'acquisizione delle immagini è veloce.
●: included, ⚬: option
| N-STORM Sistema di microscopio a Super-Risoluzione |
N-SIM S Sistema di microscopio a Super-Risoluzione |
N-SIM E Sistema di microscopio a Super-Risoluzione |
Yokogawa CSU-W1 SoRa Sistema di super risoluzione a disco rotante |
|
|---|---|---|---|---|
| Limite di risoluzione ottica relativa | ~20 nm (XY)* ~50 nm (Z)* |
~115 nm (XY)* ~86 nm (XY; modalità TIRF-SIM)* ~269 nm (Z; modalità SIM 3D)* |
~115 nm (XY)* ~269 nm (Z; modalità SIM 3D)* |
~120 nm (XY)* |
| Limite di profondità di imaging relativo | ~ 5 μm | ~ 10 – 20 μm | ~ 10 – 20 μm | ~ 50 – 100 μm |
| Velocità di acquisizione immagini supportata | ~0.1 FPS (acquisizione fino a 500 Hz di singoli fotogrammi di immagine) |
~15 FPS (solo SIM 2D e SIM TIRF) |
~1 FPS (tutte le modalità) |
~30+ FPS (limitato solo da segnale-rumore, velocità di rotazione del disco e velocità di lettura della telecamera) |
| Canali spettrali supportati | 3 | 6 | 3 | 6 |
| Area massima di acquisizione immagini | 80 x 80 μm (usando l'obiettivo 100X) |
66 x 66 μm (usando l'obiettivo 100X) |
66 x 66 μm (usando l'obiettivo 100X) |
61 x 57 μm (utilizzando un obiettivo 100X con lente di ingrandimento 2,8X) |
| Supporti per microscopio compatibili | N-STORM | N-SIM S | N-SIM E | CSU-W1 SoRa |
| ECLIPSE Ti2-E Invertito | yes | yes | yes | yes |
| ECLIPSE Ti2-A Invertito | no | no | no | yes |
| ECLIPSE Ti2-U Invertito | no | no | no | yes |
* Questi valori sono forniti come riferimento approssimativo. Le prestazioni della risoluzione variano a seconda delle condizioni esatte. Non vengono fornite stime di risoluzione per le dimensioni per le quali non è previsto il miglioramento.
Letteratura correlata
Discussione sull'imaging su scala nanometrica
Trova il metodo di super risoluzione che fa per te
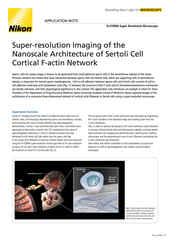
Analisi quantitativa della colonna vertebrale con stack Z di 3D-SIM, 35 passaggi, intervallo Z: 4,2 um
Tempo di esposizione 100 ms, intervalli di 120 sec
Time-lapse di 11 volte
Lunghezza d'onda di eccitazione 488 nm
Informazioni di esempio: colonna vertebrale dendritica nel neurone ippocampale del topo che esprime GFP
Film per gentile concessione di: Drs. Yutaro Kashiwagi e Shigeo Okabe, Dipartimento di Neurobiologia Cellulare, Scuola di Specializzazione in Medicina e Facoltà di Medicina, Università di Tokyo.
Le tecniche di imaging a super risoluzione forniscono un miglioramento della risoluzione oltre il limite di diffrazione, ma ogni tecnica ha anche i suoi limiti e compromessi che dovrebbero essere ben compresi per determinare quale è più adatta alla tua ricerca.
Innanzitutto, le velocità di acquisizione della super risoluzione sono generalmente più lente rispetto alle tecniche tradizionali. L'imaging con N-STORM è difficile da applicare sulle cellule vive a causa della velocità di acquisizione più lenta (che richiede quasi universalmente più di un secondo per fotogramma). STORM e altre tecniche SMLM forniscono il massimo miglioramento della risoluzione, ma sono compatibili con un numero limitato di fluorofori, molti dei quali richiedono sistemi tampone specializzati che non sono compatibili con le cellule vive.
N-SIM S e Yokogawa CSU-W1-SoRa sono più adatti per l'imaging di cellule vive a super risoluzione poiché supportano velocità di imaging più elevate (15 FPS per N-SIM S, maggiore per CSU-W1-SoRa) e possono essere utilizzati con fluorofori convenzionali senza sistemi tampone specifici.
Obiettivi ad alte prestazioni per una super risoluzione
Obiettivo Nikon con collare di correzione automatizzato montato su un microscopio invertito Ti2-E
Uno dei fattori più critici per quanto riguarda la massimizzazione della risoluzione ottica è la scelta dell'obiettivo. Ciò vale sia per la super risoluzione che per altre tecniche di imaging.
L'apertura numerica (NA) della lente dell'obiettivo dovrebbe essere la più alta possibile mentre si utilizza ancora un mezzo di immersione appropriato. Gli obiettivi per microscopio Nikon Super-Resolution Series includono CFI SR HP Apochromat TIRF 100XC Oil (immersione in olio, NA = 1,49), CFI SR HP Plan Apochromat Lambda S 100XC Sil (immersione in silicone, NA = 1,35) e CFI SR Plan Apocromatico IR 60XC WI (immersione in acqua, NA = 1,27). Questi obiettivi forniscono alcune delle NA di più alto livello nelle rispettive classi.
Gli obiettivi selezionati della serie Super-Resolution sono disponibili con un collare di correzione automatica, che consente una regolazione molto precisa della correzione dell'aberrazione sferica senza regolazione manuale, garantendo la risoluzione di livello più elevato e le prestazioni di imaging 3D possibili.
Risoluzione migliorata: superare i limiti delle tecnologie tradizionali
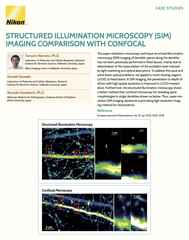
Immagini confocali a scansione puntiforme di ciglia cocleari. Viste XY e XZ con (destra) e senza (sinistra) impostazioni di risoluzione avanzate applicate.
A volte la risoluzione necessaria per rispondere alla tua domanda non è molto al di là del convenzionale e quindi potrebbe non richiedere alcuni dei compromessi richiesti dai metodi di super risoluzione. In tal caso, ti consigliamo di considerare il potenziale di ciò che chiamiamo imaging confocale a “risoluzione avanzata”.
Che cos'è l'imaging confocale a risoluzione avanzata? Il punto chiave da capire è che il microscopio confocale tradizionale è già in grado di ottenere un certo grado di miglioramento della risoluzione oltre a quanto è possibile con un tipico microscopio a campo ampio, con un limite teorico di ~140 nm (XY) ben descritto. Tuttavia, il raggiungimento di questo limite richiede l'uso di un pinhole infinitamente piccolo. Fortunatamente, in pratica, una dimensione pinhole di ~ 0,5 unità Airy può essere combinata con la deconvoluzione iterativa 3D post-acquisizione per avvicinarsi a questo limite, con una risoluzione di ~ 160 nm (XY) che è un obiettivo realistico per una gamma di condizioni di imaging.
I microscopi confocali a scansione puntiforme Nikon AX / AX R sono in grado di ottenere immagini a risoluzione migliorata. I vantaggi includono la possibilità di sintonizzare con precisione il rilevamento per la maggior parte dei fluorofori dello spettro visibile e il supporto dell'acquisizione simultanea di un massimo di quattro canali spettrali. Il pinhole è a variazione continua e ha una forma esagonale (piuttosto che quadrata), consentendo una regolazione più precisa. Con il modello confocale a scansione risonante AX R, è possibile acquisire immagini a velocità video (30 FPS) e più velocemente, beneficiando comunque di una risoluzione migliorata.
Glossario
- Area massima di acquisizione immagini
- Il campo visivo più ampio (misurato nello spazio campionario) supportato dalla tecnica utilizzando il fattore di ingrandimento della lente dell'obiettivo specificato.
- Canali spettrali supportati
- Questo si riferisce al numero di possibili canali spettrali (colore) supportati (assumendo una linea laser per ogni tipo di fluoroforo).
- Limite di profondità di imaging relativo
- Ciò indica l'intervallo di profondità Z (assiale) approssimativo entro il quale il sistema indicato può fornire immagini con qualità di sezionamento ottico e rapporto segnale-rumore sufficienti. Questo valore può essere abbastanza variabile e dipende fortemente dalle proprietà ottiche del campione e del recipiente, nonché dall'etichettatura.
- Limite di risoluzione ottica relativa
- Il limite di risoluzione pratica del sistema dato. Il valore per la risoluzione laterale (XY) è in genere diverso da quello per la risoluzione assiale (Z). Se non viene fornito un valore di risoluzione Z, non viene fornito alcun miglioramento in quella dimensione.
- Supporti per microscopio compatibili
- Questo si riferisce ai modelli di supporto per microscopio Nikon compatibili con ciascun sistema.
- Velocità di acquisizione immagini supportata
- Le frequenze sono mostrate come fotogrammi al secondo (FPS).
- Casa
- Applicazioni
- Scienze della vita
- Imaging su scala nanometrica