- it Change Region
- Global Site
- Casa
- Applicazioni
- Scienze della vita
- Elettrofisiologia
Elettrofisiologia

L'elettrofisiologia è lo studio delle proprietà elettriche dei campioni biologici. Questo termine si riferisce sia ai classici metodi di registrazione elettrica su scala di tessuto/organo utilizzati in ambito clinico (ad es. elettrocardiografia), sia ai metodi di registrazione a livello cellulare/subcellulare tipicamente eseguiti in combinazione con un microscopio ottico in un laboratorio di ricerca e di interesse qui. La registrazione patch-clamp continua ad essere lo standard per la registrazione dell'attività elettrica in singole cellule neurali o muscolari (o singoli canali ionici). La registrazione può essere eseguita all'interno di una varietà di sistemi modello, comprese colture cellulari in vitro, tessuto asportato e in vivo.
I metodi di registrazione del patch clamp richiedono l'aspirazione di un “patch” della membrana cellulare utilizzando una pipetta di vetro spessa micrometri (posizionata utilizzando un sistema di micromanipolazione). Un sottile filo d'argento all'interno della pipetta consente la registrazione elettrica. I metodi di patch a cellule intere e patch perforate consentono inoltre di aggiungere colorazioni fluorescenti (ad es. indicatori di tensione, di calcio) per l'osservazione microscopica, oltre ad altri agenti sperimentali.
Prodotti per Elettrofisiologia
Il microscopio verticale ECLIPSE FN1 è la soluzione principale di microscopi di Nikon per applicazioni di elettrofisiologia. Questo microscopio è dotato di un sottile telaio a forma di I che dà la priorità all'accesso al campione, fornendo spazio per il posizionamento di micromanipolatori e altre apparecchiature. Il portaobiettivi a due posizioni anteriore/posteriore consente il cambio degli obiettivi, l'obiettivo viene retratto di 15 mm quando si passa da una posizione all'altra per evitare di disturbare il campione e l'attrezzatura di micromanipolazione.
L’FN1 è compatibile con una gamma di soluzioni confocali e multifotoniche per imaging più profonde. I microscopi confocali a disco rotante della serie CSU di Yokogawa consentono un rapido sezionamento ottico in cellule vive e sezioni di tessuto. I microscopi confocali Nikon AX / AX R sono strumenti a scansione puntiforme, che consentono imaging più profondo rispetto a un disco rotante. L'AX R è il modello a scansione risonante ed è in grado di acquisire immagini a una velocità fino a 720 fotogrammi al secondo (FPS; modalità di scansione a 2048 x 16 bande), consentendo l'imaging della dinamica del calcio e altre dinamiche altrettanto veloci.
●: included, ⚬: option
| ECLIPSE FN1 Microscopio verticale (solo campo ampio) |
Yokogawa CSU-X1 Disco rotante confocale* |
Yokogawa CSU-W1 Disco rotante confocale* | AX / AX R Sistema confocale* |
A1 MP+ / A1R HD MP+ Sistema multifotonico* |
|
|---|---|---|---|---|---|
| Campo visivo | Diagonale da 25 mm (widefield; circolare) |
10 x 7 mm (confocale; rettangolare) |
17 x 16 mm (confocale; rettangolare) |
Diagonale 25 mm (confocale; quadrato) |
Diagonale 18 mm (multifotone; quadrato) |
| Ingrandimento dello zoom | 0.35X, 2.0X, 4X (widefield; con doppia porta FN-DP e variatore di ingrandimento) 1.0X, 1.25X, 1.5X, 2.0X (widefield; con torretta cambia ingrandimento FN-MT) | 1 – 1000X (confocale; zoom a scansione a variazione continua) | 1 – 1000X (multifotone; zoom a scansione a variazione continua) | ||
| Limite di profondità di imaging relativo | ~ 5 μm ~ 15 – 25 μm (con deconvoluzione) |
~ 50 μm | ~ 50 – 100 μm | ~ 100 – 500 μm | ~ 1,4 mm (con eccitazione a 1300 nm) |
| Tecniche di contrasto compatibili | ECLIPSE FN1 | CSU-X1* | CSU-W1* | AX / AX R* | A1 MP+ / A1R HD MP+* |
| Campo luminoso | yes | no | no | no | no |
| Confocale - Scansione puntiforme | no | no | no | yes | yes |
| Confocale - Disco rotante | no | yes | yes | no | no |
| Contrasto di interferenza differenziale (DIC) | yes | no | no | no | no |
| DIC a infrarossi (IR-DIC) | yes | no | no | no | no |
| Multifotone - Scansione di punti | no | no | no | no | yes |
| Illuminazione obliqua | yes | no | no | no | no |
| Luce polarizzata semplice | yes | no | no | no | no |
| Fluorescenza ad ampio campo | yes | no | no | no | no |
*La compatibilità di un sistema confocale e multifotone in questa tabella con tecniche di contrasto aggiuntive dipende dal supporto per microscopio a cui è collegato il sistema. Ad esempio, la configurazione di un sistema confocale AX / AX R su un microscopio ECLIPSE FN1 consentirebbe di utilizzare tecniche di contrasto compatibili con FN1.
Letteratura correlata
Discussione di elettrofisiologia
Tecniche di contrasto per l'uso negli esperimenti di elettrofisiologia
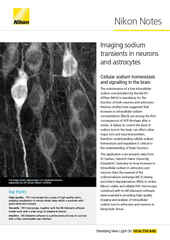
Immagine IR-DIC di patch clamp di neurone acquisito utilizzando un microscopio verticale FN1.
Sebbene la marcatura a fluorescenza dei campioni utilizzati negli esperimenti di elettrofisiologia sia abbastanza comune, non è richiesta per la registrazione del patch-clamp. Pertanto, per visualizzare il campione viene solitamente utilizzata una tecnica di imaging senza marcatura, che può risultare difficile poiché i campioni sono spesso piuttosto spessi (ad esempio, fette di cervello che sono spesse centinaia di μm), diffondono la luce e limitano la profondità con cui è possibile eseguire un'osservazione sufficientemente dettagliata.
Sebbene le tecniche senza marcatura come la microscopia in campo chiaro e contrasto di fase possano essere utili per campioni più sottili, come colture cellulari aderenti, non sono adatte per l'imaging in sezioni di tessuto spesso o in vivo. Il contrasto di interferenza differenziale (DIC) è un'opzione grazie alla sua capacità di sezionamento ottico, che consente immagini più profonde pur mantenendo un'alta risoluzione (DIC utilizza l'intera apertura numerica dell'obiettivo).
Sfortunatamente, il DIC da solo è spesso insufficiente. Per questo motivo, Nikon offre DIC (IR-DIC) nel vicino infrarosso, che utilizza l'illuminazione nel vicino infrarosso (NIR) e componenti ottiche compatibili. La luce NIR penetra ulteriormente nei campioni in dispersione grazie alle lunghezze d'onda più lunghe della luce NIR rispetto alla luce visibile, rendendo possibile identificare i singoli neuroni a profondità in cui la luce visibile DIC non riesce.
Lenti obiettive per esperimenti di elettrofisiologia
I microscopi sono generalmente configurati con lenti dell'obiettivo a immersione in acqua per esperimenti di elettrofisiologia, in cui la punta della lente è immersa direttamente nel mezzo campione acquoso (senza vetro di copertura). Gli obiettivi di immersione in acqua per l'elettrofisiologia hanno spesso punte fatte di un materiale chimicamente inerte ed elettricamente isolante, come la ceramica. Anche il fattore di forma della lente dell'obiettivo è importante, la punta dell'obiettivo dovrebbe avere un angolo di approccio ripido verso la punta per fornire il massimo accesso al campione per i micromanipolatori.
Gli obiettivi CFI60 Water Dipping Series presentano elevati gradi di correzione dell'aberrazione e trasmittanza nel NIR, rendendoli adatti per la ricerca in elettrofisiologia, specialmente in combinazione con IR-DIC o imaging multifotonico. Tutti gli obiettivi CFI60 Water Dipping sono compatibili con IR-DIC, con gli obiettivi NIR 40X W e NIR 60X W che beneficiano inoltre della loro trasmissione NIR migliorata. Il CFI Plan 100XC W è dotato di un collare di correzione per la correzione dell'aberrazione sferica.
Gli obiettivi Nikon CFI75 Water Dipping Series includono obiettivi ad immersione d'acqua 16X e 25X e sono fisicamente più grandi degli obiettivi CFI60 di Nikon, con una dimensione di filettatura di M32 e una distanza parafocale di 75 mm per adattarsi alle grandi ottiche necessarie per raccogliere la luce a un angolo sufficientemente ampio per ottenere un'elevata apertura numerica (NA) insieme a una maggiore distanza di lavoro. Il CFI75 LWD 16X W è una scelta popolare come “soluzione a obiettivo singolo”, con ingrandimenti di 5,6X, 32X e 64X accessibili utilizzando il commutatore di ingrandimento e doppia porta FN-DP. Il CFI75 Apochromat 25XC W 1300 è uno degli obiettivi più luminosi prodotti da Nikon e presenta un'elevata trasmittanza e correzione dell'aberrazione fino a 1300 nm. Tutti gli obiettivi CFI75 Water Dipping sono anche compatibili con IR-DIC.
Configurazione del microscopio per l'elettrofisiologia e l'optogenetica
La stimolazione optogenetica delle cellule che esprimono attuatori optogenetici per varie funzioni, come il canale ionico light-gated channelrhodopsin-2 (ChR2), è un metodo popolare per una varietà di applicazioni sperimentali. La stimolazione elettrica optogenetica delle cellule neurali e muscolari è completata dalla registrazione del patch clamp come lettura. Questo metodo consente di valutare direttamente le connessioni funzionali locali ea lungo raggio di diversi neuroni. La stimolazione optogenetica viene generalmente ottenuta utilizzando l'illuminazione modellata da un dispositivo di fotostimolazione dedicato.
Il microscopio ECLIPSE FN1 può essere configurato con un dispositivo di fotostimolazione a punto singolo regolabile manualmente o da un dispositivo a microspecchio digitale (DMD). I DMD consentono l'applicazione di schemi di illuminazione arbitrari con una struttura limitata a quasi diffrazione. Ciò consente un preciso targeting da cellula a subcellulare della stimolazione con schemi programmabili dall'utente e velocità di commutazione fino a 4000 Hz.
Glossario
- Campo visivo
- Il campo visivo del sistema, indicato anche come numero di campo, è il diametro dell'area di imaging con un ingrandimento nominale di 1X.
- Ingrandimento dello zoom
- L'ingrandimento dello zoom in un microscopio a campo largo è generalmente fornito otticamente, ad esempio con un accessorio di cambio ingrandimento che fornisce un numero preimpostato di opzioni, come nel il microscopio FN1. I sistemi confocali e multifotonici a scansione puntiforme di solito si basano sullo zoom di scansione, in cui lo zoom ottico viene simulato scansionando solo una piccola regione pur mantenendo un'elevata risoluzione dei pixel.
- Limite di profondità di imaging relativo
- Ciò indica l'intervallo di profondità Z (assiale) approssimativo entro il quale il sistema indicato può fornire immagini con qualità di sezionamento ottico e rapporto segnale-rumore sufficienti. Questo valore può essere abbastanza variabile e dipende fortemente dalle proprietà ottiche del campione e del recipiente, nonché dalla marcatura.
- Tecniche di contrasto compatibili
- Tipicamente, i sistemi di microscopi per l'elettrofisiologia sono in grado di utilizzare almeno una tecnica a luce trasmessa per supportare l'imaging senza etichetta, come IR-DIC. Una modalità di imaging a fluorescenza (widefield, confocale o multifotone) può essere necessaria anche per diversi esperimenti.
- Casa
- Applicazioni
- Scienze della vita
- Elettrofisiologia