- es Change Region
- Global Site
- Casa
- Aplicaciones
- Ciencias Biológicas
- Electrofisiología
Electrofisiología

La electrofisiología es el estudio de las propiedades eléctricas de muestras biológicas. Éste término puede referirse tanto a los métodos clásicos de registro eléctrico a escala de tejido/órgano utilizados en entornos clínicos (p. ej., electrocardiografía), así como a los métodos de registro a nivel celular/sub-celular que normalmente se realizan junto con un microscopio óptico en un laboratorio de investigación y de interés aquí. La grabación Patch-clamp continúa sirviendo como el estándar para registrar la actividad eléctrica en células nerviosas o musculares individuales (o canales iónicos individuales). El registro se puede realizar dentro de una variedad de sistemas modelo, incluidos cultivos celulares in vitro, tejido extirpado e in vivo.
Los métodos de registro Patch clamp requieren la succión de un “pedazo” de la membrana celular usando una pipeta de vidrio de micrómetros de espesor (colocada usando un sistema de micromanipulación). Un alambre fino de plata dentro de la pipeta permite el registro eléctrico. Los métodos de :pedazos de células completas y pedazos perforados también permiten agregar tinciones fluorescentes (p. ej., indicadores de voltaje, calcio) para la observación microscópica, además de otros agentes experimentales.
Productos para Electrofisiología
El microscopio vertical ECLIPSE FN1 es la principal solución de microscopio de Nikon para aplicaciones de electrofisiología. Este microscopio cuenta con una base delgada en forma de I que prioriza el acceso a la muestra, proporcionando espacio para el posicionamiento de micromanipuladores y otros equipos. El revólver portaobjetivos deslizante frontal/posterior de 2 posiciones permite el cambio de objetivos, el objetivo se retrae 15 mm cuando se cambia de posición para evitar perturbar la muestra y el equipo de micromanipulación.
El FN1 es compatible con una variedad de soluciones confocales y multifotónicas para obtener imágenes más profundas. Los microscopios confocales de barrido de campo de la serie CSU de Yokogawa permiten un seccionamiento óptico rápido en células vivas y cortes de tejido. Los microscopios confocales Nikon AX/AX R son instrumentos de escaneo de barrido por puntos, que permiten obtener imágenes más profundas que con un barrido de campo. El AX R es el modelo de escaneo resonante y es capaz de generar imágenes a una velocidad de hasta 720 cuadros por segundo (FPS; modo de escaneo de banda de 2048 x 16), lo que permite obtener imágenes de la dinámica del calcio y otras dinámicas igualmente rápidas.
●: Incluido, ⚬: Opcional
| ECLIPSE FN1 Microscopio vertical (solo campo amplio) |
Yokogawa CSU-X1 Confocal de Barrido de campo* |
Yokogawa CSU-W1 Confocal de Barrido de campo* | AX / AX R Sistema Confocal* |
A1 MP+ / A1R HD MP+ Sistema Multifotónico* |
|
|---|---|---|---|---|---|
| Campo de visión | 25 mm en diagonal (campo amplio; circular) | 10 x 7 mm (confocal; rectangular) | 17 x 16 mm (confocal; rectangular) |
Diagonal de 25 mm (confocal; cuadrada) | Diagonal de 18 mm (multifotón; cuadrado) |
| Ampliación de Zoom | 0,35X, 2,0X, 4X (campo amplio; con puerto doble FN-DP y cambiador de aumentos) 1,0X, 1,25X, 1,5X, 2,0X (campo amplio; con torreta cambiadora de aumentos FN-MT) | 1 - 1000X (confocal; zoom de escaneo continuamente variable) | 1 - 1000X (multifotónico; zoom de escaneo continuamente variable) | ||
| Límite de profundidad de imagen relativa | ~ 5 μm ~ 15 – 25 μm (con desconvolución) |
~ 50 μm | ~ 50 – 100 μm | ~ 100 – 500 μm | ~ 1,4 mm (con excitación de 1300 nm) |
| Técnicas de contraste compatibles | ECLIPSE FN1 | CSU-X1* | CSU-W1* | AX / AX R* | A1 MP+ / A1R HD MP+* |
| Campo Claro | yes | no | no | no | no |
| Confocal - Escaneo de barrido | no | no | no | yes | yes |
| Confocal - Barrido de campo | no | yes | yes | no | no |
| Contraste de interferencia diferencial (DIC) | yes | no | no | no | no |
| DIC infrarrojo (IR-DIC) | yes | no | no | no | no |
| Multifotón - Escaneo de barrido de puntos | no | no | no | no | yes |
| Iluminación oblicua | yes | no | no | no | no |
| Luz polarizada simple | yes | no | no | no | no |
| Fluorescencia de campo amplio | yes | no | no | no | no |
*La compatibilidad de un sistema confocal y multifotónico en esta tabla con técnicas de contraste adicionales depende de la base del microscopio al que esté conectado el sistema. Por ejemplo, la configuración un sistema confocal AX/AX R en un microscopio ECLIPSE FN1 permitiría utilizar técnicas de contraste compatibles con el FN1.
Literatura relacionada
Discusión de Electrofisiología
Técnicas de contraste para su uso en experimentos de electrofisiología
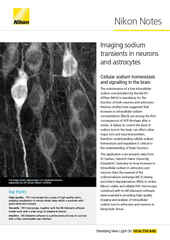
Imagen IR-DIC de una neurona sujeta con parche en tejido cerebral explantado adquirida con un microscopio vertical FN1.
Si bien la tinción con fluorescencia de muestras utilizadas en experimentos de electrofisiología es bastante común, no es necesario para el registro de patch-clamp. Por lo tanto, normalmente se emplea una técnica de formación de imágenes sin tinciones para visualizar la muestra. Esto puede ser un desafío ya que las muestras suelen ser bastante gruesas (e. j., cortes de cerebro de cientos de μm de grosor), lo que dispersa la luz y limita la profundidad con la que se puede realizar una observación suficientemente detallada.
Si bien las técnicas sin tinciones, como la microscopía de contraste de fase y de campo claro, pueden ser útiles para muestras más delgadas, como cultivos de células adherentes, no son adecuadas para obtener imágenes en secciones de tejido grueso o in vivo. El contraste de interferencia diferencial (DIC) es una opción debido a su capacidad de seccionamiento óptico, lo que permite adquirir imágenes más profundas mientras mantiene una alta resolución (DIC utiliza la apertura numérica completa de la lente del objetivo).
Desafortunadamente, la DIC por sí sola a menudo no es suficiente. Por esta razón, Nikon ofrece DIC de infrarrojo cercano (IR-DIC), que utiliza iluminación de infrarrojo cercano (NIR) y componentes ópticos compatibles. La luz NIR penetra más en las muestras que producen dispersión gracias a las longitudes de onda más largas de la luz NIR en comparación con la luz visible, lo que permite identificar neuronas individuales a profundidades donde falla la luz visible DIC.
Lentes objetivas para experimentos de electrofisiología
Los microscopios generalmente se configuran con lentes de objetivo de inmersión en agua para experimentos de electrofisiología, donde la punta de la lente se sumerge directamente en el medio acuoso de la muestra (sin cubreobjetos). Los objetivos de inmersión en agua para electrofisiología a menudo tienen puntas hechas de un material químicamente inerte y eléctricamente aislante, como la cerámica. El factor de forma de la lente del objetivo también es importante, la punta del objetivo debe tener un ángulo de aproximación pronunciado hacia la punta para proporcionar el máximo acceso a la muestra de los micro-manipuladores.
Los objetivos de la serie de Inmersión en Agua CFI60 de Nikon presentan altos grados de corrección de aberraciones y transmitancia en el NIR, lo que los hace adecuados para la investigación electrofisiológica, especialmente en combinación con IR-DIC o imágenes multifotónicas. Todas las lentes del objetivo CFI60 de Inmersión en Agua son compatibles con IR-DIC, y las lentes NIR 40X W y NIR 60X W se benefician además de su transmisión NIR mejorada. El CFI Plan 100XC W cuenta con un collar de corrección para la corrección de la aberración esférica.
Los objetivos de la serie de inmersión en agua CFI75 de Nikon incluyen lentes de inmersión en agua de 16X y 25X, y son físicamente más grandes que las lentes CFI60 de Nikon, presentando un tamaño de rosca de M32 y una distancia parafocal de 75 mm para adaptarse a los componentes ópticos de gran tamaño necesarios para captar la luz a un ángulo lo suficientemente amplio para lograr una apertura numérica alta (NA) junto con una distancia de trabajo más larga. El CFI75 LWD 16X W es una opción popular como “solución de objetivo único” con aumentos de 5, 6X, 32X y 64X accesibles mediante el cambiador de aumento y puerto doble FN-DP. El CFI75 Apochromat 25XC W 1300 es uno de los objetivos más brillantes que fabrica Nikon y cuenta con alta transmitancia y corrección de aberraciones hasta 1300 nm. Todos los objetivos de inmersión en agua CFI75 también son compatibles con IR-DIC.
Configuración de microscopios para electrofisiología y optogenética
La estimulación optogenética de células que expresan actuadores optogenéticos para diversas funciones, como el canal iónico canalrodopsina-2 (ChR2), es un método popular para una variedad de aplicaciones experimentales. La estimulación eléctrica optogenética de las células nerviosas y musculares se complementa con el registro de pinzamiento de parche como lectura. Este método permite evaluar directamente las conexiones funcionales locales y de largo alcance de diferentes neuronas. La estimulación optogenética generalmente se logra usando iluminación modulada de un dispositivo de fotoestimulación especializado.
El microscopio ECLIPSE FN1 se puede configurar con un dispositivo de fotoestimulación de un solo punto ajustable manualmente o un dispositivo de microespejo digital (DMD). Los DMD permiten la aplicación de patrones de iluminación arbitrarios con una estructura limitada de difracción cercana. Esto permite una orientación precisa de la estimulación desde celular a sub-celular con patrones programables por el usuario y velocidades de conmutación de hasta 4000 Hz.
Glosario
- Ampliación de Zoom
- La ampliación de zoom en un microscopio de campo amplio generalmente se proporciona ópticamente, por ejemplo, con un accesorio de cambio de ampliación que proporciona un número preestablecido de opciones, como con el microscopio FN1. Los sistemas confocales y multifotónicos de barrido de puntos generalmente se basan en el zoom de escaneo, donde el zoom óptico se simula al escanear solo una pequeña región mientras se mantiene una alta resolución de píxeles.
- Campo de visión
- El campo de visión del sistema, también denominado número de campo, es el diámetro del área de imagen con un aumento nominal de 1X.
- Límite de profundidad de imagen relativa
- Esto indica el rango de profundidad Z (axial) aproximado dentro del cual el sistema indicado puede producir imágenes con suficiente calidad de seccionamiento óptico y relación señal/ruido. Este valor puede ser bastante variable y depende en gran medida de las propiedades ópticas de la muestra y el recipiente, así como de la tinción.
- Técnicas de contraste compatibles
- Por lo general, los sistemas de microscopía para electrofisiología son capaces de utilizar al menos una técnica de luz transmitida para adquirir imágenes sin fluorófoross, como IR-DIC. También puede ser necesaria una modalidad de imágenes de fluorescencia (campo amplio, confocal o multifotónica) para diferentes experimentos.
- Casa
- Aplicaciones
- Ciencias Biológicas
- Electrofisiología