- zh Change Region
- Global Site
活细胞成像
活细胞显微技术特别是是荧光成像,对于现代细胞生物学研究的重要性是不容忽视的。活细胞荧光成像使得长期观察特定生物分子的动态和互作成为可能。过去几十年大量的技术创新推动了活细胞成像的实用化,包括开发作为基因表达和特定标记的荧光蛋白。活细胞成像一般搭载倒置显微镜进行,以便更好地容纳充满介质的培养/成像容器。
活细胞成像产品
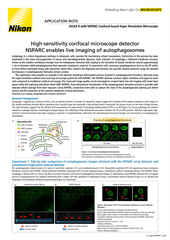
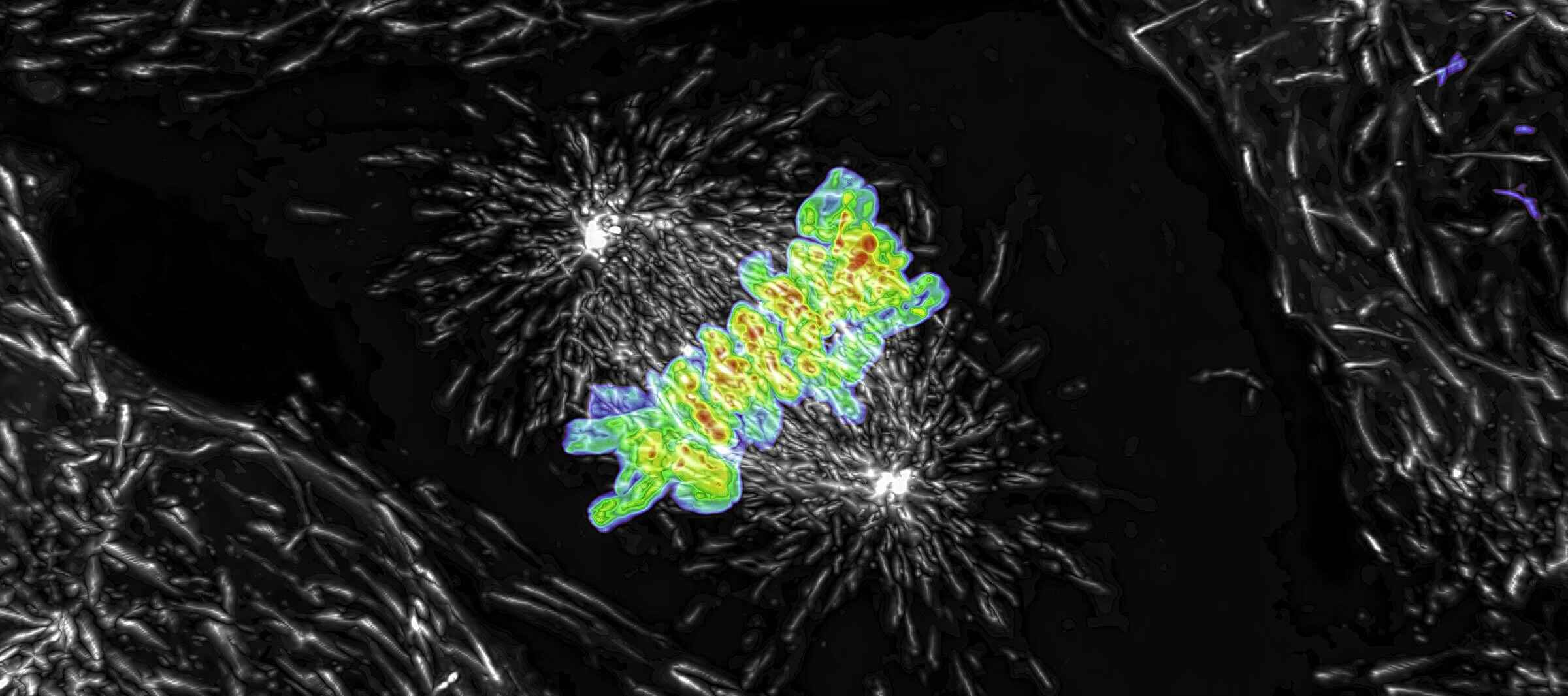
一个有丝分裂活细胞Z stack成像的最大强度投影,使用AX R共振扫描器采集,采用15 FPS速率和2048×1024像素分辨率。物镜为CFI Plan Apo Lambda 60X Oil,数值孔径1.4。
Ti2-E电动倒置显微镜是推荐的活细胞成像用镜座。该款显微镜可与在此详述的所有共聚焦和超分辨率选件组合使用。完美对焦系统4(PFS4)是业界领先的基于硬件的焦点锁定技术,实现了无焦点漂移且兼容玻璃和塑料培养容器的长期活细胞成像。还可以为水浸物镜配置自动补水装置。
Ti2-LAPP模块化照明系统使得一台显微镜可以组合多达五种不同的照明模块,可提供针对TIRF、宽场落射荧光和光刺激的选件,包括FRAP装置和数字微镜装置(DMD)。通过在一个镜座上配置多个TIRF照明器模块,可以同时进行多通道TIRF成像,且每条激光线都具有最佳TIRF角度。
BioPipeline LIVE高内涵成像系统专门配置在Ti2-E上。该系统包含一个与细胞培养箱直接连接的显微镜培养围舱,并配备最多可实现44个不同容器自动高内涵成像的样本交换机械臂。
AX / AX R共聚焦显微镜是尼康的点扫描共聚焦解决方案。其中AX R包含支持512×512像素下30帧/秒(FPS)视频成像速率的快速共振扫描系统。Denoise.ai软件模块也支持该系统,其能自动消除共振扫描共聚焦图像中的主要噪点来源——散粒噪点。
数码倒置显微镜 ECLIPSE Ji 采用与 Ti2-E 相同的完美对焦系统 (PFS)。通过连接载物台顶部培养箱,可控制二氧化碳浓度、湿度和温度,从而实现长时间的活细胞成像。将AX / AX R与ECLIPSE Ji 连接,可以进行上述高速采集,使用Denoise.ai消除散粒噪点,以及实现厚样品成像。
横河电机CSU系列转盘式共聚焦系统是常见的活细胞成像解决方案。CSU-X1以其光路效率高和转盘转速快而成为CSU系列中的最佳型号。CSU-W1因针孔间距宽而更适于较厚模型系统(如类器官)的成像,因为宽孔间距能减少相邻针孔之间的信号串扰,从而在分散样本中达到更深的成像深度。
超分辨率显微术使得活细胞成像应用进一步精细化和实用化。横河电机CSU-W1 SoRa是一种转盘式共聚焦设备,其所集成的发射微透镜盘通过光学像素再分配实现超分辨率成像。
●: 包含, ⚬: 选配
| ECLIPSE Ti2-E倒置显微镜(宽场成像)* | BioPipeline LIVE高内涵成像系统 | AX R共振共聚焦系统 | 用横河电机CSU-X1实现转盘成像 | 用横河电机CSU-W1实现转盘成像 | 用Ti2-LAPP E-TIRF照明器实现TIRF成像 | 使用横河电机CSU-W1 SoRa实现超分辨率成像 | |
|---|---|---|---|---|---|---|---|
| 相对成像深度极限 | ~ 5 μm ~ 15 – 25 μm(配合反卷积) |
~ 5 μm ~15 – 25 μm (配合反卷积) 当与选配的共聚焦系统组合时,成像深度可能更深 |
~ 100 – 500 μm | ~ 50 μm | ~ 50 – 100 μm | ~ 100 – 300 nm | ~ 50 – 100 μm |
| 支持视频速率成像 | 支持
(受相机系统限制) |
支持
(受相机系统限制) |
支持(512×512下扫描成像速率为30 FPS) | 支持
(受相机系统限制) |
支持
(受相机系统限制) |
支持
(受相机系统限制) |
支持
(受相机系统限制) |
| 视野 | 25 mm对角线(圆形) | 25 mm对角线(圆形) | 25 mm对角线(正方形) | 10×7 mm(长方形) | 17×16 mm(长方形) | ~ 10 mm 对角线(圆形) | 17×16 mm(长方形) |
| 支持的成像模式 | ECLIPSE Ti2-E | BioPipeline LIVE | AX R | CSU-X1 | CSU-W1 | Ti2-LAPP E-TIRF | CSU-W1 SoRa |
| 明场 | yes | no | no | no | no | no | no |
| 点扫描共聚焦 | no | optional | yes | no | no | no | no |
| 转盘式共聚焦 | no | optional | no | yes | yes | no | yes |
| 暗场 | yes | no | no | no | no | no | no |
| 微分干涉相差(DIC) | yes | no | no | no | no | no | no |
| 尼康高级调制相差(NAMC) | yes | no | no | no | no | no | no |
| 相差 | yes | no | no | no | no | no | no |
| 超分辨率光学像素再分配显微镜 | no | optional | no | no | no | no | yes |
| 全内反射荧光(TIRF) | no | no | no | no | no | yes | no |
| 容积对比 | yes | no | no | no | no | no | no |
| 宽场荧光 | yes | no | no | no | no | no | no |
| 兼容镜座 | ECLIPSE Ti2-E | BioPipeline LIVE | AX R | CSU-X1 | CSU-W1 | Ti2-LAPP E-TIRF | CSU-W1 SoRa |
| ECLIPSE Ti2-E倒置显微镜 | no | yes | yes | yes | yes | yes | yes |
| ECLIPSE Ti2-A倒置显微镜 | no | no | no | yes | yes | no | yes |
| ECLIPSE Ti2-U倒置显微镜 | no | no | no | yes | yes | no | yes |
| ECLPSE Ji数码倒置显微镜 | no | no | yes | no | no | no | no |
| ECLIPSE Ni-E正置显微镜 | no | no | yes | yes | yes | no | no |
| ECLIPSE Ni-U正置显微镜 | no | no | no | yes | yes | no | no |
| ECLIPSE FN1正置显微镜 | no | no | yes | yes | yes | no | no |
*该行专指使用Ti2-E进行宽场成像。Ti2-E是与表中列出的其他系统一起使用的推荐显微镜镜座。
相关文献
关于活细胞成像
活细胞成像的艺术与科学
尼康BioPipeline LIVE系统包括与细胞培养箱无缝连接的完整显微镜围舱型培养系统。
尼康硅油系列物镜。该系列物镜均具备数值孔径高、工作距离长的特点,还提供有校正环,适合温度依赖性环境。
活细胞成像要求用户认真权衡成像条件:目的是收集最低限度的基本数据,减小模型系统的扰动。虽然使用更大的照明功率、更长的相机曝光时间等来获得更高信噪比(SNR)的图像很有诱惑力,但必须清楚的是,光毒性反应可能破坏生理结构完整性并影响系统的持续存活能力。此外,光漂白实际限制了实验过程中能从每个荧光团提取的光子数量。
活细胞成像实验的一个重要方面是控制环境条件:维持相关系统正确的气体混合、温度和湿度。使用较小的台面培养装置或使用较大的围舱系统将显微镜的大部分包围起来均可控制环境条件。顶级第三方制造商都能提供专为尼康显微镜设计的台面插件和较大的显微镜围舱。
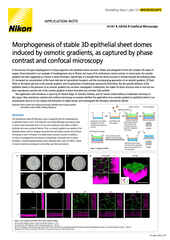
物镜的选择是另一个要考虑的因素。高数值孔径(NA)油浸物镜可能更适合扁平细胞中盖玻片附近的成像特征,但会产生球面像差。在样本中的成像深度越深,球面像差越严重。造成球面像差的原因是细胞/培养介质的折射率(RI)比玻璃/油的折射率低。对于深度成像和3D成像应用而言,建议使用浸没介质折射率更接近成像环境折射率的物镜(如水或硅油)。
CFI Apochromat Lambda S物镜系列包括各种水浸物镜,如CFI Plan Apochromat IR 60XC WI。据我们所知,该款物镜是数值孔径(NA = 1.27)最高的水浸物镜。尼康近期还推出了硅油系列物镜。硅油的折射率约为1.4,更接近细胞环境且具有比水浸物镜更高的数值孔径。这些物镜更适合3D培养系统(如类器官)的成像。
减小活细胞中的光毒性和光漂白
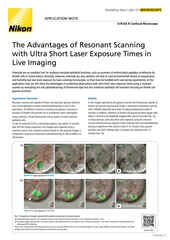
硬件触发极大加快了总实验时间。大多数实例中的相机曝光时间比相机读出时间长。
a最后一行列出相机的曝光时间与读出时间相同的一组对比,并表明相机能够在重叠模式(占空比100%)下运行。
荧光成像技术需要的强照射对细胞健康是天生有害的,高能(蓝移)波长尤其如此。尽管并未过分禁止继续使用常见的绿色荧光团(如EGFP),且绿色荧光团在许多多色成像应用中仍有不错的表现,但仍建议采用红/近红外荧光团进行成像。
大多数显微镜都通过软件来触发系统设备。然而,由于计算机时钟相对不精确而需要检查和回调设备状态,因此软件触发的响应速度可能较慢。相反,硬件触发使用精度更高的相机像素时钟来协调系统设备,且无需设备回调,从而能最大程度地提高系统响应速度并尽量减小光子剂量。被触发的设备可包括Z轴压电载物台、激光/LED照明器,甚至是具有I/O通信能力的自定义设备。
触发还应虑及更复杂的照明模式。例如,可利用尼康NIS-Elements软件仅在sCMOS相机的所有像素曝光时才照亮样本(考虑卷帘快门效应)——与连续照明和自由运行图像采集相比,减少了光子剂量和光漂白。还可在曝光期间利用各种LED和激光照明器实现微秒级脉冲照明。微秒级脉冲照明为激发到三重态的荧光团留出了恢复到基态的额外时间,因此有助于避开主要光漂白途径。
利用基于深度学习的人工智能改善活细胞成像
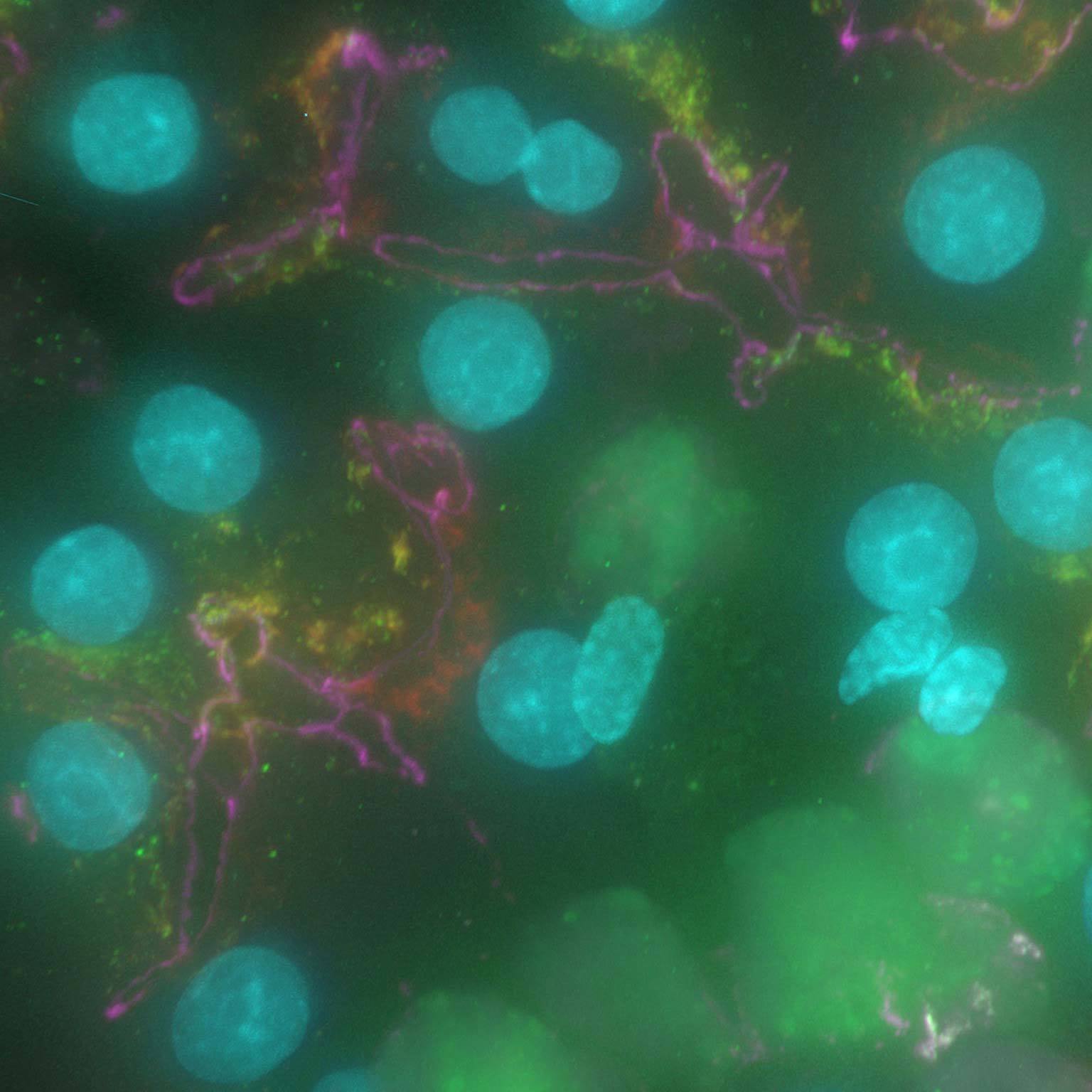
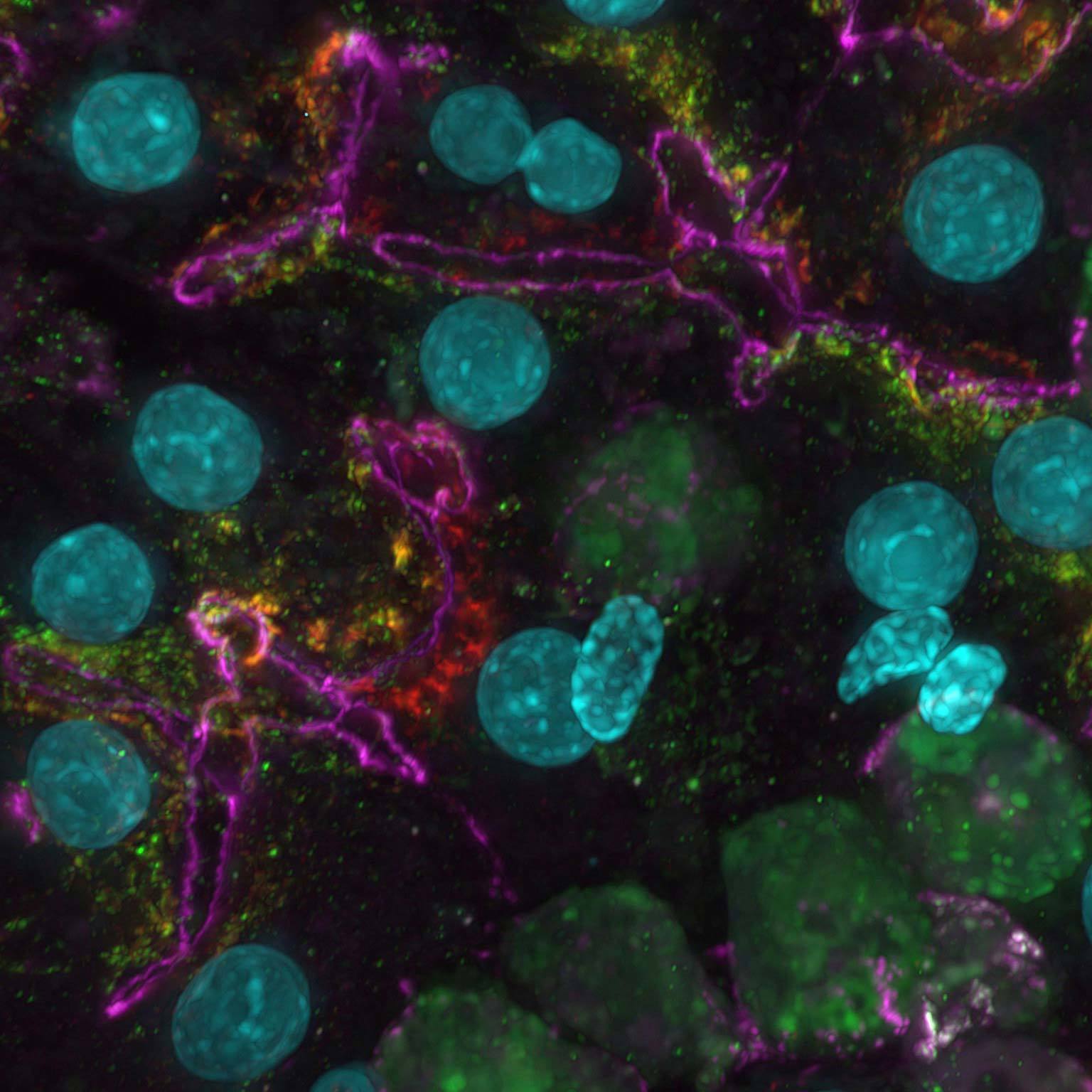
荧光图像可能会由于散射光或焦外光而模糊,但是基于AI的工具能够通过去除噪点和模糊来恢复高对比度图像。
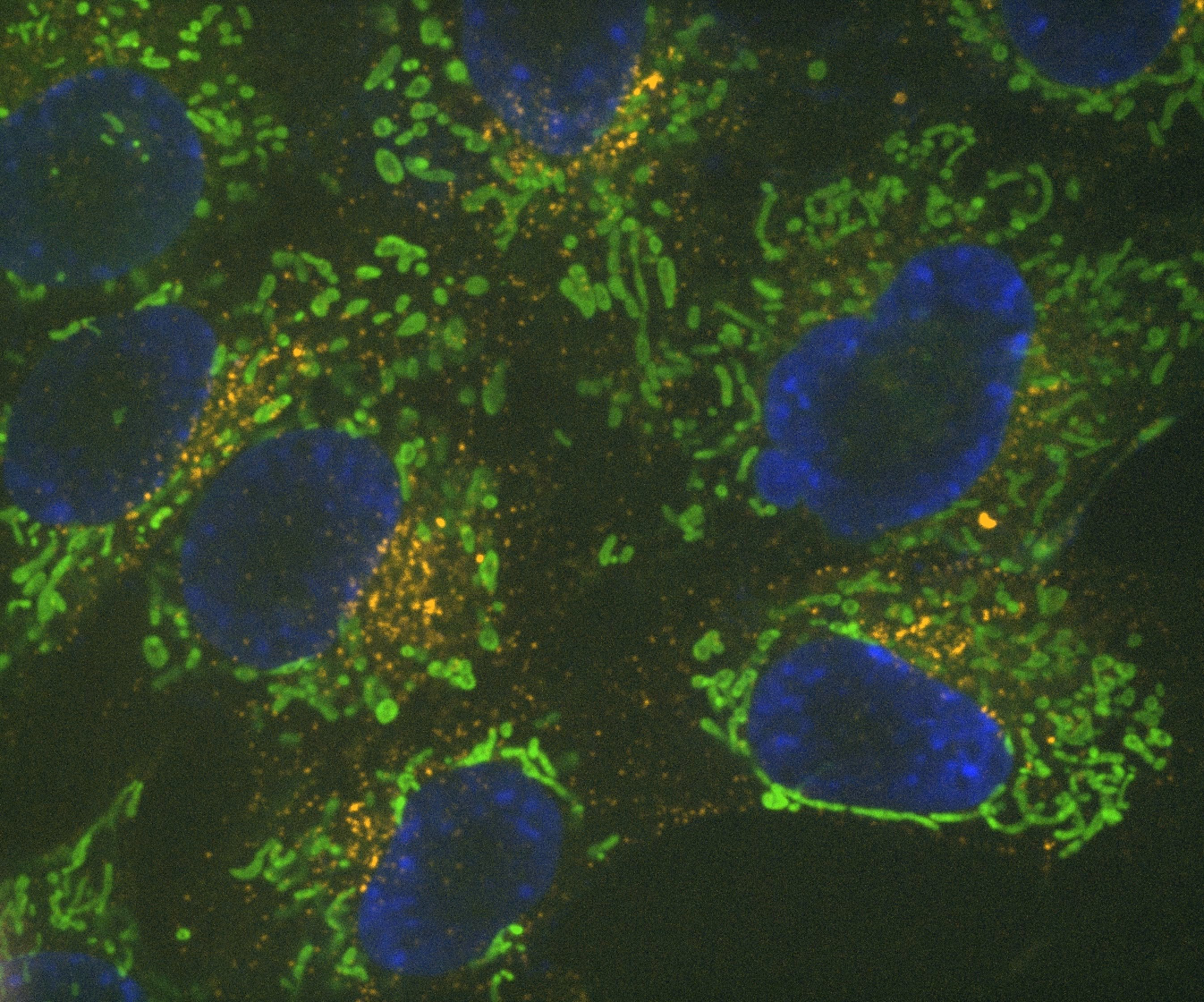
Denoise.ai 可去除图像中的散粒噪声成分并保留图像基础结构与强度信号。
人工智能(AI)在显微术中的崭露头角为活细胞成像开启了新的可能并减少了光子剂量。基于深度学习的方法证明适合基于生物样本图像的分析。尼康致力于开发稳定的基于深度学习的软件解决方案,例如NIS-Elements软件的NIS.ai模块,以适用于各种应用领域。
Clarify.ai能自动清除标准宽场荧光图像中的焦外模糊。该模块出厂前经过了预训练,无需用户对最终图像进行手动调整,杜绝了主观偏差的可能。Clarify.ai还允许以最大系统速度在单平面宽场图像上进行光切,而不像使用宽场数据3D迭代反卷积那样需要来自多个平面的数据。
Denoise.ai是另一个经过预训练的模块,用于实时消除共聚焦图像中的泊松噪点(散粒噪点)。该模块可减少曝光时间,与运用AX R共聚焦显微镜获得的共振扫描图像(这种图像的主要噪点来源是散粒噪点)配合使用时,能得到很好的降噪效果
尼康还提供用于预测图像特征的Convert.ai模块,通常是基于已有明场图像的特征,预测对应的某个荧光通道的特征(例如预测DIC图像数据中的DAPI细胞核染色图案),而得到类似荧光通道的预测图像。Convert.ai 可减少荧光成像通道的使用,避免荧光成像技术需要的强照明。而明场成像技术天然具有较弱的光毒性。
可训练Enhance.ai模块可预测低信噪比(SNR)图像中的细节,有效提高信噪比,允许以更少的光子剂量实现成像并减少光漂白。
哪种成像方式最适合您的研究呢?
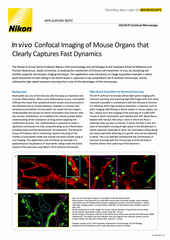
NIS-Elements软件3D迭代反卷积前(a)和反卷积后(b)16 μm厚组织切片中小鼠肾小球的宽场荧光图像。
对于相对扁平的二维样本而言,例如体外培养的贴壁细胞,宽场荧光成像或许已够用。而当使用Clarify.ai软件模块将宽场成像与反卷积分析或自动去模糊结合在一起时,兼容的用例和样本类型将更为广泛。
虽然共聚焦成像是厚度大于~20 μm的样本成像的必然选择,但其对厚度仅为几个μm的样本的高分辨率成像也有一定的帮助。转盘式共聚焦仪器成像速度快,适合~50 μm以下的样本(其中CSU-W1因针孔间距更大而比其他型号的成像深度更深)。这两个系统都适合不同类型3D细胞培养系统的成像,如类器官和球状体。
点扫描共聚焦的成像更深,最高可达到几百μm的成像深度。AX R共聚焦系统上采用的共振扫描器能够提供视频速率成像,结合Denoise.ai模块后可实时消除散粒噪点。与转盘式系统不同,AX R共聚焦系统的针孔是连续可调的,在使用任何兼容的物镜时,可优化光切和分辨率。
全内反射荧光(TIRF)成像是一种专门观察细胞与盖玻片界面几百纳米以内的细胞特征的光切技术。其可提高信噪比,允许使用更低的激光功率保护细胞健康和/或最大化成像速度。尼康的CFI Apochromat TIRF系列物镜还具有极高的数值孔径(NA = 1.49)。
超分辨率显微术针对的是需要衍射极限以外的光学分辨率来分辨必要细节的场合。为了提高分辨率,必须对纷杂的技术进行取舍,因此活细胞超分辨率显微术一般具有一定的挑战性。横河电机CSU-W1 SoRa是一种在转盘式共聚焦系统环境中实现的超分辨率系统,可按与CSU-W1匹配的速度成像(假设信号充分)。
虽然荧光成像技术十分强大,可多路探测不同的分子靶标,但明场成像技术(如相差和微分干涉相差(DIC))能以极低的光子剂量提供细节丰富的细胞图像。虽然这些技术可能缺乏所需的分子特异性,但在实验过程中偶尔采集明场图像来帮助评估细胞健康不失为一种良好实践。
词汇表
- 兼容镜座
- 指兼容各系统的尼康显微镜镜座型号。
- 支持的成像模式
- 指每种系统提供的各种显微成像技术。需要指出的是,在使用ECLIPSE Ti2-E倒置显微镜作为此表所列系统的配置基础上,其支持的几乎所有成像模式均可实现。
- 支持视频速率成像
- “视频速率”的传统定义是30帧/秒(FPS)左右。最佳成像速率视具体应用可能比30 FPS快,也可能比30 FPS慢。EM-CCD相机的典型成像速率可达到60 FPS(全幅),sCMOS相机则可达到40-100 FPS(全幅)。
- 相对成像深度极限
- 表示指定系统在保证图像的光切质量和信噪比的前提下,成像的近似Z(轴)深度范围。该值可能相差很大,且与标本和容器以及荧光标记情况密切相关。
- 视野
- 系统的视野(也称视场数)定义为标称1X放大倍率下成像区域的直径。