- es Change Region
- Global Site
- Casa
- Aplicaciones
- Ciencias Biológicas
- Captura de imágenes de células vivas
Captura de imágenes de células vivas
Es difícil subestimar la importancia de la microscopía de células vivas, en particular las adquisición de imágenes de fluorescencia, para la investigación moderna en biología celular. Las captura de imágenes de fluorescencia de células vivas permiten observar la dinámica y las interacciones de biomoléculas específicas durante largos períodos de tiempo. Numerosas innovaciones tecnológicas en las últimas décadas han contribuido a la utilidad de la captura de imágenes en vivo, incluido el desarrollo de proteínas fluorescentes expresadas genéticamente y etiquetas específicas. La adquisición de imágenes de células vivas se realiza normalmente con un microscopio invertido para adaptarse mejor a los recipientes de adquisición de imágenes/cultivo llenos de medio.
Productos para la captura de imágenes de células vivas
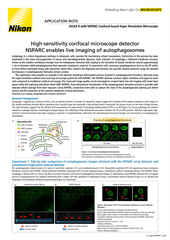
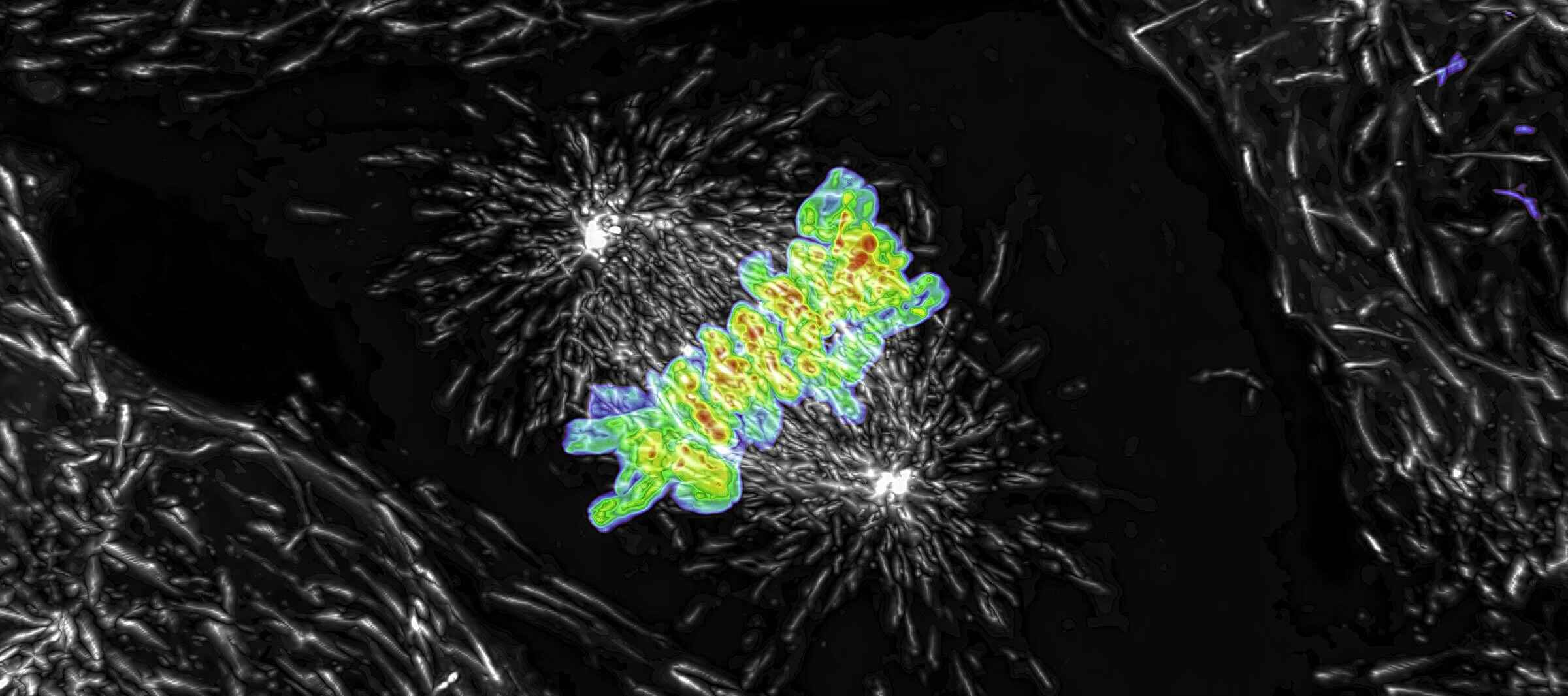
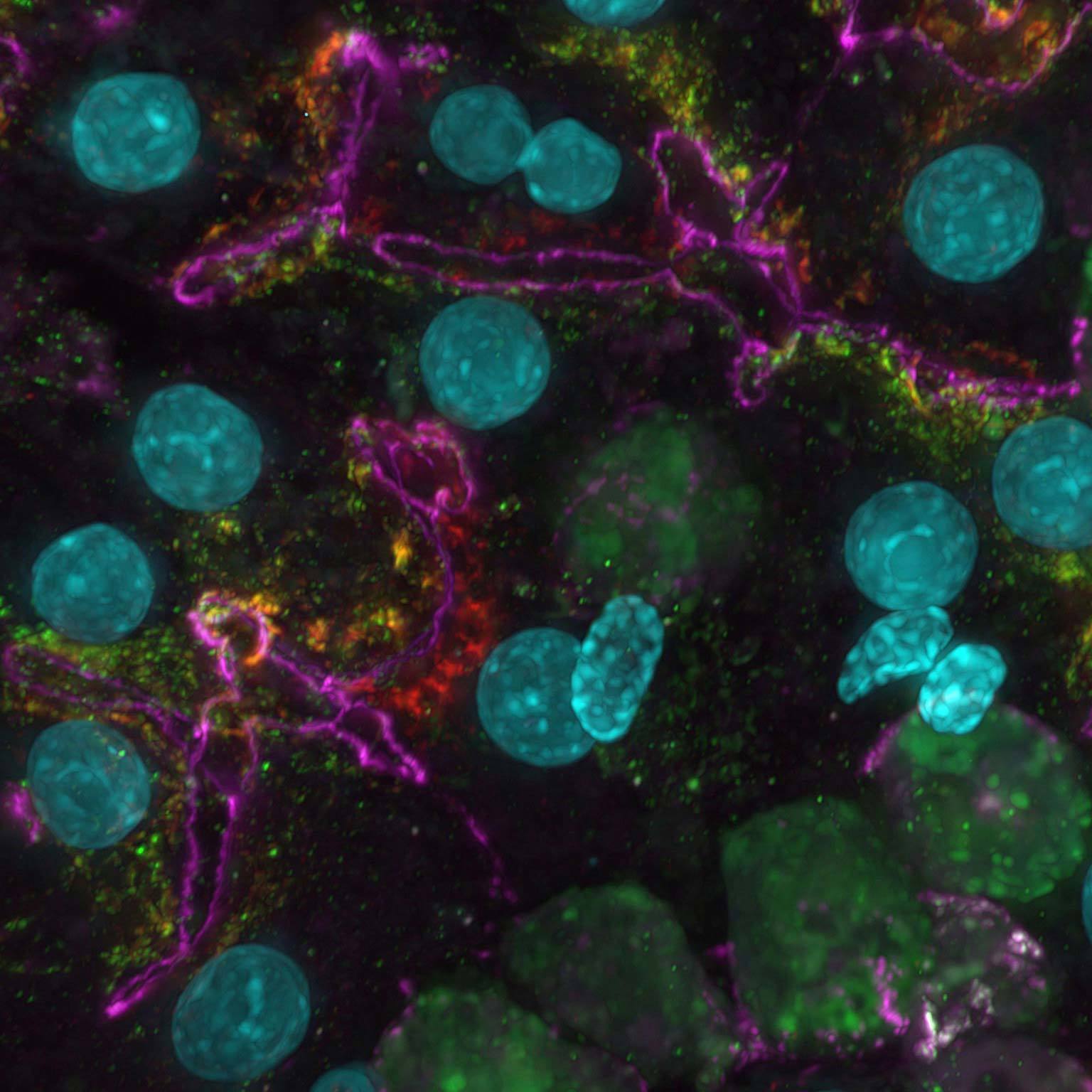
Proyección de máxima intensidad de una pila de Z recolectada de una célula mitótica viva, adquirida con el escáner resonante AX R que opera a 15 FPS y una resolución de píxeles de 2048 x 1024. La lente del objetivo era un aceite CFI Plan Apo Lambda 60X, 1.4 NA
El microscopio invertido motorizado ECLIPSE Ti2-E es la base de microscopio recomendado para obtener imágenes de células vivas; se puede combinar con todas las opciones confocales y de superresolución que se detallan aquí. Perfect Focus System 4 (PFS4) es la tecnología de mantenimiento de enfoque basada en hardware líder en la industria, que permite obtener imágenes de células vivas a largo plazo sin desviación focal y compatible con recipientes de cultivo de vidrio y plástico. También está disponible un dispensador automático de agua para objetivos de inmersión en agua.
El sistema de iluminación modular Ti2-LAPP permite combinar un solo microscopio con hasta cinco módulos de iluminación diferentes, con opciones disponibles para TIRF, epifluorescencia de campo amplio y fotoestimulación, incluidos dispositivos FRAP y dispositivos de microespejos digitales (DMD). Es posible configurar varios módulos de iluminación TIRF en un solo soporte, lo que permite obtener imágenes multicanal simultáneas con el ángulo TIRF óptimo para cada línea láser.
Los microscopios confocales AX / AX R son las soluciones confocales de barrido por puntos de Nikon, con el AX R que presenta un sistema de escaneo resonante rápido que proporciona una adquisición de imágenes de velocidad de video de 30 cuadros por segundo (FPS) a 512 x 512 píxeles. Esto está respaldado además por el módulo de software Denoise.ai, que elimina automáticamente el ruido de disparo, la principal fuente de ruido en las imágenes confocales de escaneo resonante.
Los sistemas confocales de barrido de campo de la serie CSU de Yokogawa son soluciones populares para la obtención de imágenes de células vivas. El CSU-W1 es mejor para obtener imágenes de sistemas de modelos más gruesos, como los organoides, debido al espacio más amplio entre los diafragmas, lo que reduce la interferencia de señales entre los orificios adyacentes, lo que permite obtener imágenes más profundas en muestras que dispersan luz.
La microscopía de súper resolución continúa siendo más refinada y práctica para las aplicaciones de imágenes de células vivas. Los modos 2D-SIM, 3D-SIM y TIRF-SIM están disponibles. El Yokogawa CSU-W1 SoRa es un instrumento confocal de barrido de campo que integra un disco de microlente de emisión para lograr una superresolución mediante la reasignación de píxeles ópticamente.
●: Incluido, ⚬: Opcional
| ECLIPSE Ti2-E Microscopio invertido (imágenes de campo amplio)* |
AX R Sistema Confocal Resonante |
CSU-X1 Escáner confocal de barrido de campo |
CSU-W1 Escáner confocal de barrido de campo |
Ti2-LAPP E-TIRF Iluminador |
N-SIM S Sistema de Super-Resolución |
CSU-W1 SoRa Sistema de superresolución de barrido de campo |
|
|---|---|---|---|---|---|---|---|
| Límite de profundidad de imagen relativa | ~ 5 μm ~ 15 – 25 μm (con deconvolución) |
~ 100 – 500 μm | ~ 50 μm | ~ 50 – 100 μm | ~ 100 – 300 nm | ~ 10 – 20 μm | ~ 50 – 100 μm |
| Produce imágenes con velocidad de video | Sí |
Sí (30 FPS with 512 x 512 scan) |
Sí |
Sí (limitado por el sistema de cámara y la velocidad de rotación del disco) |
Sí (limitado por el sistema de cámaras) |
No (15 FPS solo con 2D-SIM y TIRF-SIM) |
Sí (limitado por el sistema de cámara y la velocidad de rotación del disco) |
| Campo de visión | diagonal de 25 mm (circular) | 25 mm diagonal (cuadrado) | 10 x 7 mm (rectangulares) | 17 x 16 mm (rectangulares) | ~ 10 mm diagonal (circular) | ~ 9.3 mm diagonal (circular) | 17 x 16 mm (rectangulares) |
| Modalidades de imágenes que se apoyan | ECLIPSE Ti2-E | AX R | CSU-X1 | CSU-W1 | Ti2-LAPP E-TIRF | N-SIM S | CSU-W1 SoRa |
| Campo Claro | yes | no | no | no | no | no | no |
| Confocal - Barrido de puntos | no | yes | no | no | no | no | no |
| Confocal – Barrido de campo | no | no | yes | yes | no | no | yes |
| Campo oscuro | yes | no | no | no | no | no | no |
| Contraste de interferencia diferencial (DIC) | yes | no | no | no | no | no | no |
| Contraste de modulación avanzada de Nikon (NAMC) | yes | no | no | no | no | no | no |
| Contraste de fase | yes | no | no | no | no | no | no |
| Super-Resolution - Structured Illumination | no | no | no | no | no | 2D-SIM, TIRF-SIM, 3D-SIM | |
| Súper resolución: microscopía de reasignación de píxeles ópticos | no | no | no | no | no | no | yes |
| Fluorescencia de reflexión interna total (TIRF) | no | no | no | no | yes | no | no |
| Fluorescencia de campo amplio | yes | no | no | no | no | no | no |
| Bases de microscopio compatibles | ECLIPSE Ti2-E | AX R | CSU-X1 | CSU-W1 | Ti2-LAPP E-TIRF | N-SIM S | CSU-W1 SoRa |
| ECLIPSE Ti2-E invertido | no | yes | yes | yes | yes | yes | yes |
| ECLIPSE Ti2-A invertido | no | no | yes | yes | no | no | yes |
| ECLIPSE Ti2-U invertido | no | no | yes | yes | no | no | yes |
| ECLIPSE Ni-E vertical | no | yes | yes | yes | no | no | no |
| ECLIPSE Ni-U vertical | no | no | yes | yes | no | no | no |
| ECLIPSE FN1 vertical | no | yes | yes | yes | no | no | no |
*Esta fila se refiere únicamente al uso de ECLIPSE Ti2-E para imágenes de campo amplio. El Ti2-E es la base de microscopio recomendada para usar junto con los otros sistemas enumerados en la tabla.
Literatura relacionada
Discusión sobre la obtención de imágenes de células vivas
El arte y la ciencia de la obtención de imágenes de células vivas
Las lentes de objetivo de la serie de inmersión de silicona de Nikon. Cada una de estas lentes proporciona NA alta, larga distancia focal y un collar de corrección con configuraciones dependientes de la temperatura.
La adquisición de imágenes de células vivas requiere que los usuarios equilibren cuidadosamente las condiciones de la captura de imagen: el objetivo es recopilar los datos esenciales mínimos, minimizando la perturbación del sistema modelo. Si bien puede ser tentador usar más potencia de iluminación, exposiciones de cámara más prolongadas, etc. para obtener imágenes con una mayor relación señal-ruido (SNR), es importante comprender que la fototoxicidad puede comprometer la integridad fisiológica y la viabilidad continua del sistema. Además, el fotoblanqueo impone un límite práctico a la cantidad de fotones que se pueden extraer de cada fluoróforo en el transcurso del experimento.
Otro factor a considerar es la elección de la lente del objetivo. Las lentes de objetivo de aceite de alta apertura numérica (NA) pueden funcionar bien para obtener imágenes de características cerca del cubreobjetos en celdas planas, pero sufren de aberración esférica a medida que se obtienen imágenes más profundas en la muestra. Esto se debe al índice de refracción (IR) más bajo de la célula/medio de cultivo en comparación con el vidrio/aceite. Para aplicaciones de imágenes más profundas y en 3D, se recomienda utilizar objetivos que utilicen medios de inmersión que coincidan más con el IR del entorno de imágenes, como agua o silicona.
La serie de objetivos CFI Apochromat Lambda S incluye una serie de lentes de objetivo de inmersión en agua, incluido el CFI Plan Apochromat IR 60XC WI, que tiene el NA más alto para un objetivo de inmersión en agua en NA = 1.27 que conocemos. Nikon ha presentado más recientemente sus lentes de objetivo de la Serie de Inmersión de Silicona. La silicona tiene un RI de aproximadamente 1,4, lo que se asemeja más al entorno celular y permite NA más altas que la inmersión en agua. Estos objetivos son adecuados para obtener imágenes de sistemas de cultivo 3D como organoides.
Minimización de la fototoxicidad y el fotoblanqueo en células vivas
La activación por hardware mejora significativamente el tiempo total del experimento. En la mayoría de estos ejemplos, el tiempo de exposición de la cámara fue mayor que el tiempo de lectura de la cámara.
a La última fila presenta una comparación para la cual el tiempo de exposición de la cámara fue el mismo que su tiempo de lectura, y la cámara pudo funcionar en modo superpuesto (100 % del ciclo de trabajo).
La intensa irradiación requerida por las técnicas de obtención de imágened basadas en fluorescencia es intrínsecamente dañina para la salud celular, especialmente con longitudes de onda de mayor energía (desplazamiento hacia el azul). Por esta razón, se recomienda el uso de fluoróforos de rojo a infrarrojo cercano, aunque el uso continuo de fluoróforos verdes populares como EGFP no es demasiado prohibitivo y continúa funcionando bien para muchas aplicaciones de imágenes multicolores.
La mayoría de los microscopios utilizan la activación de software de los dispositivos del sistema. Sin embargo, esto puede ser algo lento debido a la relativa imprecisión del reloj de la computadora y las comprobaciones y devoluciones de llamada requeridas de los estados del dispositivo. Por el contrario, la activación por hardware utiliza el reloj de píxeles de la cámara de alta precisión para coordinar los dispositivos y omitir las devoluciones de llamada de los dispositivos, lo que maximiza la velocidad del sistema y minimiza la dosis de fotones. Los dispositivos activados pueden incluir platinas piezoeléctricas Z, iluminadores láser/LED e incluso dispositivos personalizados con capacidad de comunicación de E/S.
La activación también permite patrones de iluminación más complejos. Por ejemplo, es posible usar el software NIS-Elements de Nikon para iluminar la muestra solo cuando todos los píxeles de una cámara sCMOS están expuestos (teniendo en cuenta el efecto del obturador rodante), lo que reduce la dosis de fotones y el fotoblanqueo en comparación con la iluminación continua y la ejecución de la adquisición de imágenes. También es posible pulsar la iluminación en la escala de tiempo de microsegundos durante la exposición con varios iluminadores LED y láser. La iluminación pulsada en esta escala de tiempo permite que los fluoróforos excitados a un estado de triplete tengan más tiempo para relajarse hasta el estado fundamental y, por lo tanto, ayudar a evitar las principales vías de fotoblanqueo.
Uso de inteligencia artificial basada en aprendizaje profundo para mejorar la adquisición de imágenes de células vivas
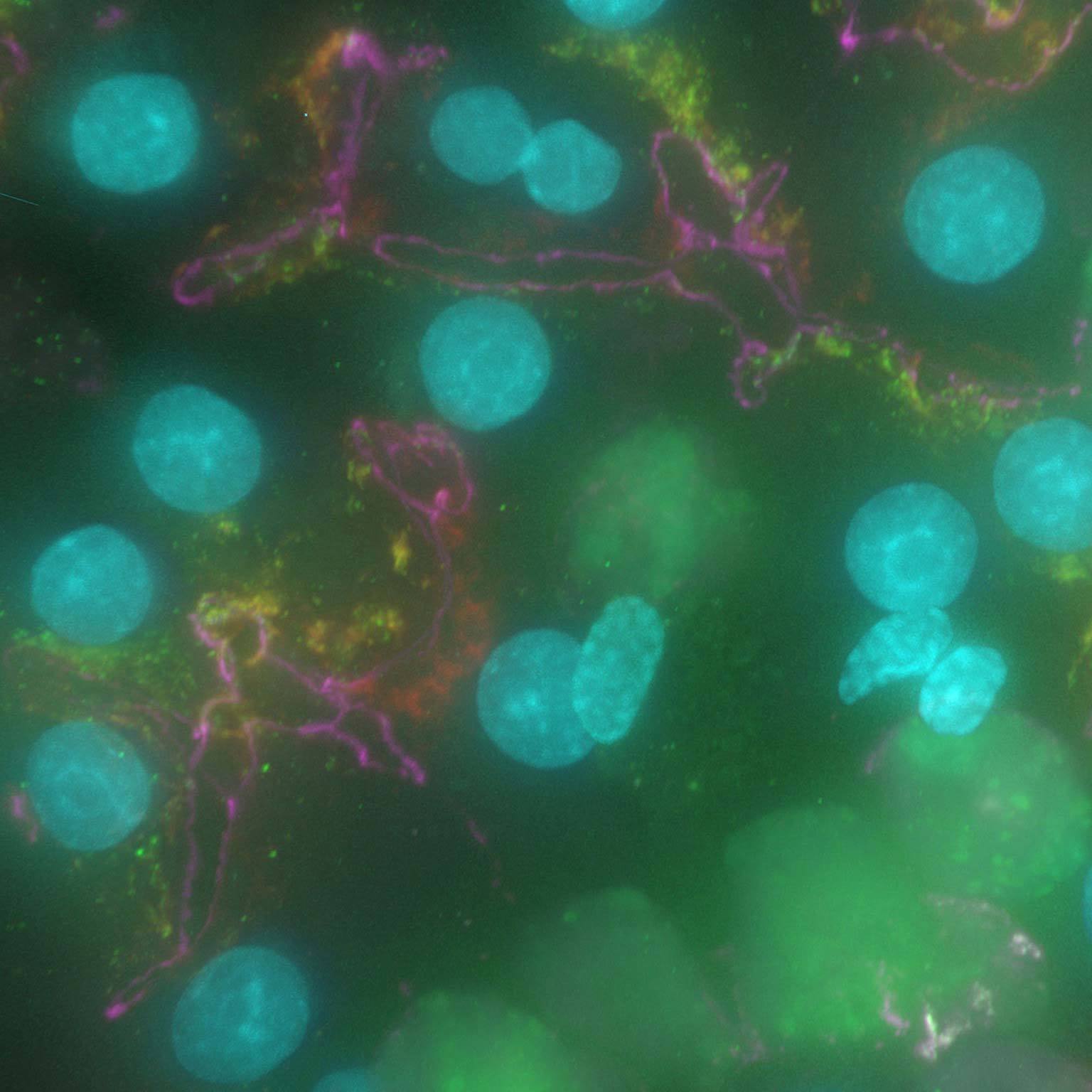
Los datos de campo amplio pueden verse contaminados por la luz dispersa y fuera de foco, pero las herramientas basadas en IA pueden recuperar imágenes de alto contraste eliminando el ruido y el desenfoque.
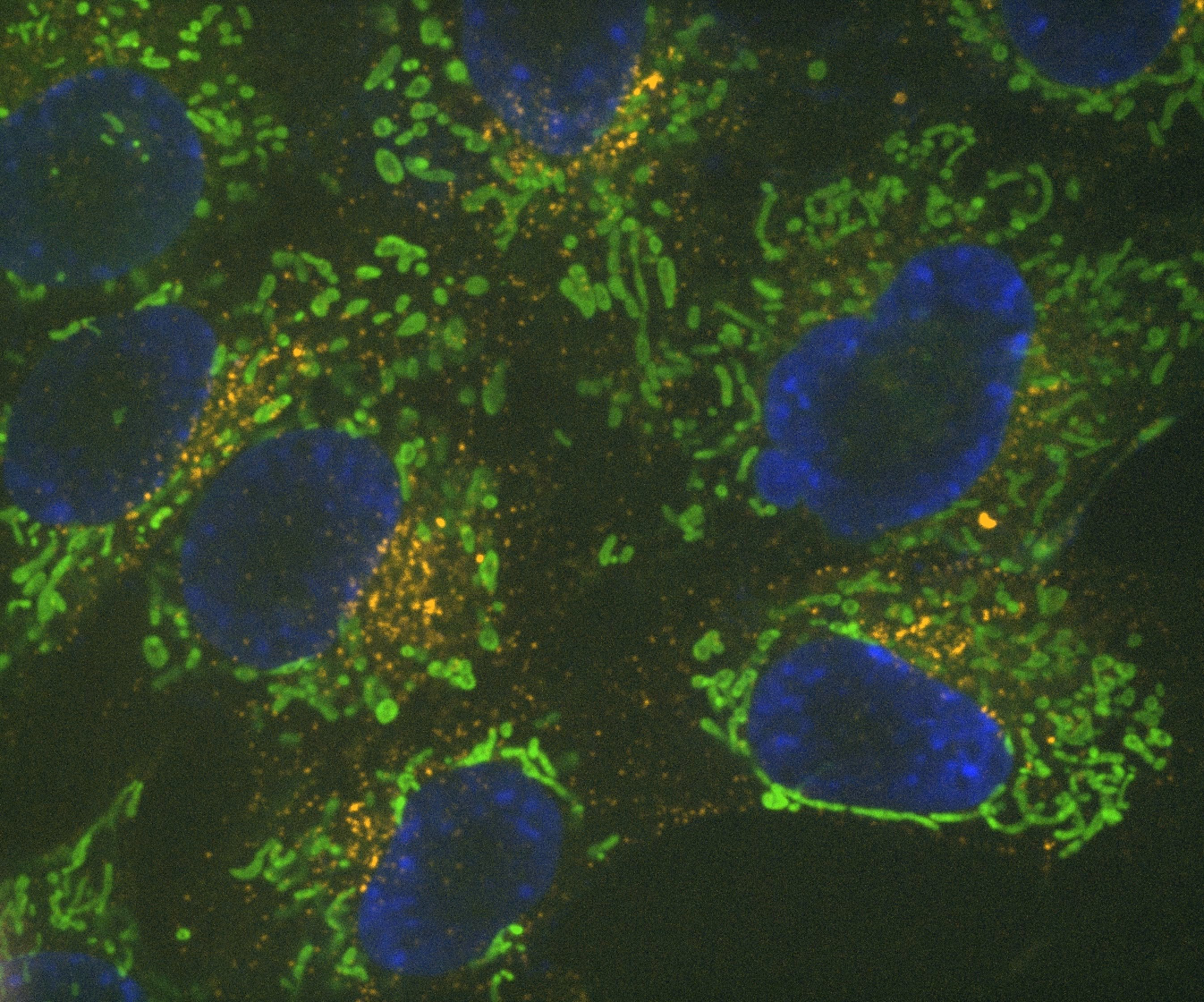
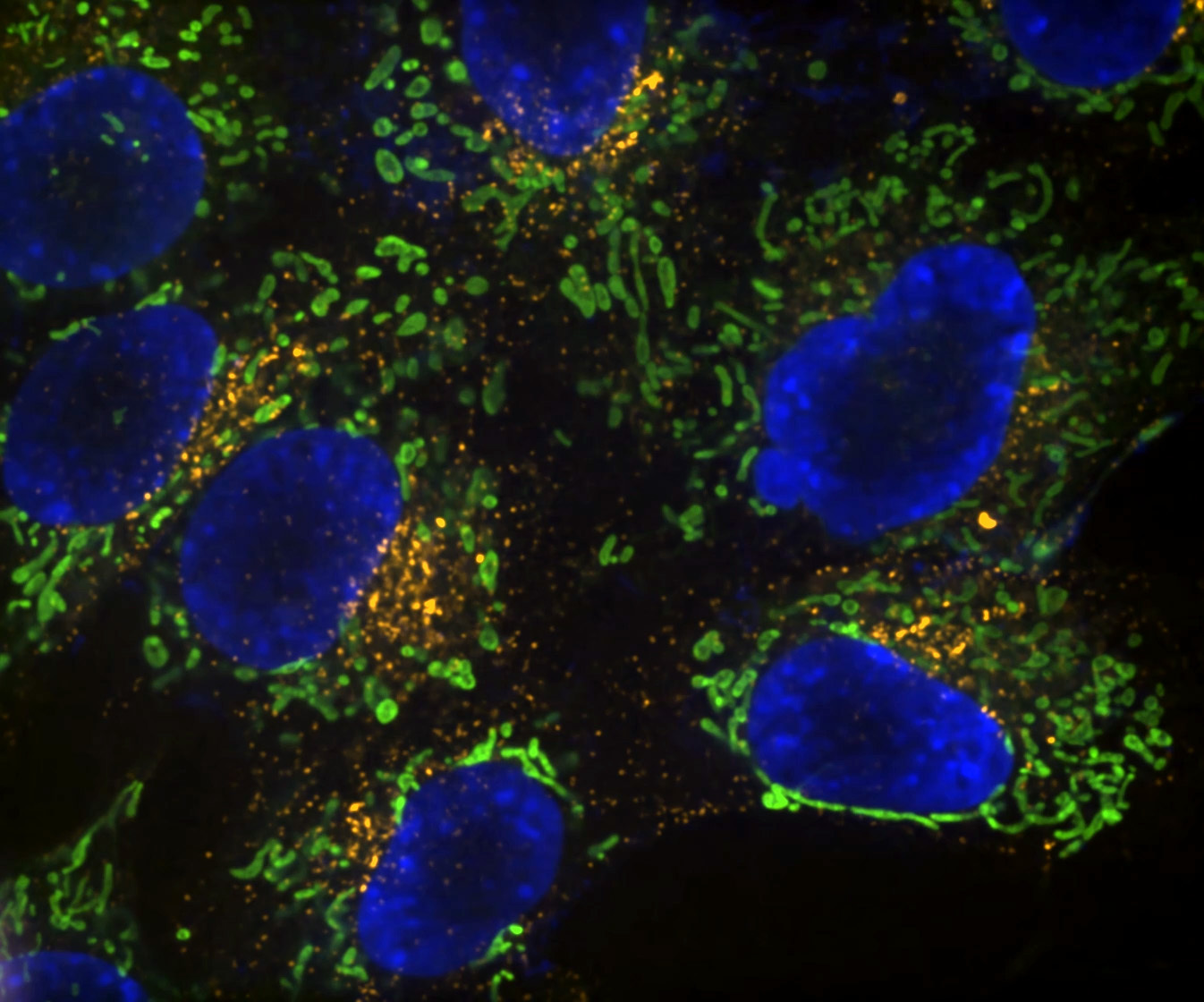
Denoise.ai se puede aplicar para eliminar el componente de ruido de disparo de las imágenes sin alterar la estructura subyacente y los valores de intensidad.
El advenimiento de los métodos de inteligencia artificial (IA) para la microscopía ha abierto nuevas posibilidades para la obtención de imágenes de células vivas con una dosis reducida de fotones. Los métodos basados en el aprendizaje profundo están demostrando ser adecuados para los ensayos basados en la obtención de imágenes de muestras biológicas. Nikon está comprometida con el desarrollo de soluciones de software estables basadas en el aprendizaje profundo para diversas aplicaciones, disponibles como módulos NIS.ai para nuestro software NIS-Elements.
Clarify.ai proporciona la eliminación automática de la luz fuera de foco de las imágenes de fluorescencia estándar de campo amplio. Este módulo se entrena previamente en nuestra fábrica y no requiere un ajuste manual de la imagen final por parte del usuario, lo que elimina la posibilidad de subjetividad. Clarify.ai permite, por lo tanto, que se realice el seccionamiento óptico en imágenes de campo amplio de un solo plano adquiridas a la velocidad máxima del sistema, sin requerir datos de múltiples planos como con la deconvolución iterativa 3D de datos de campo amplio.
Denoise.ai es otro módulo preentrenado y se usa para eliminar el ruido de Poisson (ruido de disparo) de las imágenes confocales en tiempo real. Esto permite tiempos de exposición reducidos y es ventajoso cuando se usa junto con imágenes de escaneo resonante adquiridas usando el microscopio confocal AX R, donde el ruido de disparo es la fuente predominante de ruido.
Nikon también ofrece el módulo Convert.ai para predecir características de imagen que normalmente se detectan en un canal de fluorescencia, con la señal predicha basada en una imagen de campo claro correspondiente (p. ej., predicción de patrones de tinción nuclear DAPI a partir de datos de imagen DIC). Esto permite eliminar los canales de fluorescencia para la adquisición de imágenes, evitando la iluminación intensa que exigen las técnicas de fluorescencia. Las técnicas de obtención de imágenes de campo claro son intrínsicamente menos fototóxicas.
Enhance.ai se puede entrenar para predecir detalles en imágenes de baja señal a ruido (SNR), mejorando de manera efectiva la SNR y permitiendo obtener imágenes con una dosis reducida de fotones y fotoblanqueo.
¿Qué técnica de contraste es adecuada para su investigación?
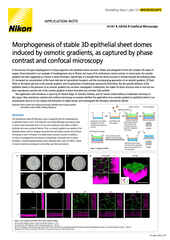
Imagen de fluorescencia de campo amplio de un glomérulo de riñón de ratón en una sección de tejido de 16 mm de espesor antes (a) y después (b) deconvolución iterativa 3D en el software NIS-Elements.
Para muestras de dos dimensiones relativamente planas, como células adherentes cultivadas in vitro, las imágenes de fluorescencia de campo amplio pueden ser suficientes. Los casos de uso compatibles y los tipos de muestras son mucho más amplios cuando se combinan imágenes de campo amplio con análisis de deconvolución o la eliminación de luz fuera de foco automáticos mediante el módulo de software Clarify.ai.
Las imágenes confocales senecesitan cuando se toman imágenes de muestras que tienen más de ~ 20 μm de grosor, pero también son útiles para la toma de imágenes de alta resolución de muestras, incluso de unos pocos μm de grosor. Los instrumentos confocales de barrido de campo son rápidos y adecuados para muestras de hasta ~50 μm (con el CSU-W1 capaz de obtener imágenes más profundas que otros modelos debido al mayor espacio entre los diafragmas). Ambos sistemas son aplicables para obtener imágenes de diferentes tipos de sistemas de cultivo celular en 3D, como organoides y esferoides.
Las imágenes confocales de barrido por punto pueden generar imágenes más profundas, hasta varios cientos de μm. El escáner resonante que se incluye en el confocal AX R puede proporcionar imágenes de velocidad de video y está diseñado para combinarse con Denoise.ai para eliminar el ruido de disparo en tiempo real. A diferencia de los sistemas de barrido de campo, el AX R cuenta con un diafragma de ajuste continuo para optimizar la resolución y el corte óptico con cualquier lente de objetivo compatible.
La adquisición de imágenes de fluorescencia de reflexión interna total (TIRF) es una técnica de corte óptico que permite la observación exclusiva de las características de las células que ocurren dentro de unos pocos cientos de nm desde la interfaz entre la célula y el cubreobjetos. Esto proporciona una mejora en la SNR, lo que permite el uso de una potencia láser más baja para proteger la salud de las células y/o maximizar la velocidad de obtención de imágenes. Los objetivos de la serie TIRF apocromáticos CFI de Nikon también cuentan con una NA muy alta de 1,49.
Las técnicas de microscopía de súper resolución son para cuando se requiere específicamente una resolución óptica más allá del límite de difracción para resolver los detalles necesarios. La microscopía de súper resolución de células vivas generalmente ha sido un desafío debido a las compensaciones exigidas de estas diversas técnicas para mejorar la resolución. El Yokogawa CSU-W1 SoRa es un sistema de superresolución implementado en el contexto de un sistema confocal de barrido de campo, lo que permite obtener imágenes a velocidades que coinciden solo con el CSU-W1 (suponiendo que haya suficiente señal).
Si bien las técnicas de obtención de imágenes de fluorescencia son potentes y permiten la detección multiplexada de distintos objetivos moleculares, las técnicas de imágenes de campo claro, como el contraste de fase y el contraste de interferencia diferencial (DIC), proporcionan imágenes celulares detalladas con una dosis de fotones significativamente menor. Si bien tales técnicas pueden carecer de la especificidad molecular requerida, es una buena práctica adquirir imágenes de campo claro ocasionales para ayudar a evaluar la salud celular en el transcurso del experimento.
Glosario
- Bases de microscopio compatibles
- Esto se refiere a los modelos de soporte de microscopio Nikon que son compatibles con cada sistema.
- Campo de visión
- El campo de visión del sistema, también denominado número de campo, es el diámetro del área de imagen con un aumento nominal de 1X.
- Límite de profundidad de imagen relativa
- Esto indica el rango de profundidad Z (axial) aproximado dentro del cual el sistema indicado puede producir imágenes con suficiente calidad de corte óptico y relación señal/ruido. Este valor puede ser bastante variable y depende en gran medida de las propiedades ópticas de la muestra y el recipiente, así como del etiquetado.
- Modalidades de imágenes que se apoyan
- Esto se refiere a las diversas técnicas de captura de imagen de microscopía proporcionadas por cada sistema. Tenga en cuenta que aún se puede acceder a casi todas las modalidades de imágenes admitidas por el microscopio invertido ECLIPSE Ti2-E cuando se utiliza como base para cualquiera de los otros sistemas enumerados en esta tabla.
- Produce imágenes con velocidad de video
- El “Video rate” se define tradicionalmente como unos 30 fotogramas por segundo (FPS). La tasa de adquisición de imagen óptima depende de la aplicación exacta y puede ser más rápida o más lenta que 30 FPS. Las cámaras EM-CCD normalmente pueden generar imágenes de hasta 60 FPS (fotograma completo) y las cámaras sCMOS de hasta 40-100 FPS (fotograma completo).
- Casa
- Aplicaciones
- Ciencias Biológicas
- Captura de imágenes de células vivas