- pt Change Region
- Global Site
- Início
- Aplicações
- Ciências da vida
- Eletrofisiologia
Eletrofisiologia

Eletrofisiologia é o estudo das propriedades elétricas de amostras biológicas. Embora este termo possa se referir a métodos clássicos de registro elétrico em escala de tecido/órgão, utilizados em ambientes clínicos (por exemplo, eletrocardiografia), também pode se referir a métodos de registro em nível celular/subcelular, normalmente realizados em conjunto com um microscópio óptico em um laboratório de pesquisa e de interesse aqui. A técnica de patch-clamp continua servindo como padrão para registrar a atividade elétrica em células individuais – neurais ou musculares (ou canais iônicos individuais). O registro pode ser realizado dentro de uma variedade de sistemas modelo, incluindo tanto culturas de células in vitro quanto tecidos ex vivo ou in vivo.
Os métodos de registro de patch-clamp requerem a sucção de uma porção (patch) da membrana celular utilizando uma pipeta de vidro de micrômetros de espessura (posicionada por meio um sistema de micromanipulação). Um fino fio de prata dentro da pipeta permite detectar as correntes elétricas. Os métodos de patch de célula inteira e patch perfurado permitem adicionalmente a adição de corantes fluorescentes (por exemplo, indicadores de voltagem, cálcio) para observação microscópica, além de outros agentes experimentais.
Produtos para Eletrofisiologia
O microscópio vertical ECLIPSE FN1 é a principal solução de microscópio da Nikon para aplicações de eletrofisiologia. Esse microscópio possui uma fina estrutura em forma de I, que prioriza o acesso à amostra, proporcionando espaço para posicionar micromanipuladores e outros equipamentos. O porta-objetivas de 2 posições (anterior/posterior) permite a troca de objetivas, sendo que, ao alternar entre as posições, a objetiva é retraída em 15 mm para evitar a perturbacão da amostra e do equipamento de micromanipulação.
O FN1 é compatível com uma variedade de sistemas confocais e multifóton para aquisição mais profunda de imagens. Os microscópios confocais de disco giratório da série CSU da Yokogawa permitem seccionamento óptico rápido em células vivas e fragmentos de tecido. Os microscópios confocais Nikon AX / AX R são instrumentos de varredura pontual, que permitem uma aquisição mais profunda de imagens, comparados aos microscópios de disco giratório. O AX R é o modelo de varredura ressonante capaz de gerar imagens a uma taxa de até 720 frames por segundo (FPS; modo de varredura 2048 x 16), permitindo capturar dinâmicas de cálcio e outras dinâmicas igualmente rápidas.
●: Incluído, ⚬: Opcional
| ECLIPSE FN1 Microscópio vertical (somente campo amplo) |
Yokogawa CSU-X1 Confocal de disco giratório* |
Yokogawa CSU-W1 Spinning Disk Confocal* | AX / AX R Sistema confocal* |
A1 MP+ / A1R HD MP+ Sistema multifóton* |
|
|---|---|---|---|---|---|
| Campo de visão | 25 mm diagonal (campo largo; circular) | 10 x 7 mm (confocal; retangular) | 17 x 16 mm (confocal; retangular) | 25 mm diagonal (confocal; quadrado) | 18 mm diagonal (multifóton; quadrado) |
| Ampliação do zoom | 0,35X, 2,0X, 4X (campo amplo; com porta dupla FN-DP e trocador de ampliação) 1,0X, 1,25X, 1,5X, 2,0X (campo amplo; com revólver trocador de ampliação FN-MT) | 1 – 1000X (confocal; zoom de varredura continuamente variável) | 1 – 1000X (multifóton; zoom de varredura continuamente variável) | ||
| Limite relativo de profundidade da aquisição de imagem | ~ 5 μm ~ 15 – 25 μm (com deconvolução) | ~ 50 μm | ~ 50 – 100 μm | ~ 100 – 500 μm | ~ 1,4 mm (com excitação de 1300 nm) |
| Técnicas de contraste compatíveis | ECLIPSE FN1 | CSU-X1* | CSU-W1* | AX / AX R* | A1 MP+ / A1R HD MP+* |
| Campo claro | yes | no | no | no | no |
| Confocal - varredura de ponto | no | no | no | yes | yes |
| Confocal - disco giratório | no | yes | yes | no | no |
| Contraste de interferência diferencial (DIC) | yes | no | no | no | no |
| DIC infravermelho (IR-DIC) | yes | no | no | no | no |
| Multifóton - varredura de ponto | no | no | no | no | yes |
| Iluminação oblíqua | yes | no | no | no | no |
| Luz polarizada simples | yes | no | no | no | no |
| Fluorescência de campo amplo | yes | no | no | no | no |
*A compatibilidade de um sistema confocal e multifóton nesta tabela com técnicas de contraste adicionais depende do suporte do microscópio ao qual o sistema está conectado. Por exemplo, a configuração de um sistema confocal AX / AX R em um microscópio ECLIPSE FN1 possibilitaria o uso de técnicas de contraste compatíveis com o FN1.
Literatura relacionada
Discussão de Eletrofisiologia
Técnicas de contraste para uso em experimentos de eletrofisiologia
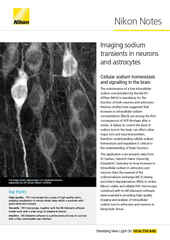
Imagem IR-DIC de neurônio ligado a uma micropipeta de vidro em tecido cerebral explantado, adquirida utilizando um microscópio vertical FN1.
Embora a marcação com fluorescência de amostras utilizadas em experimentos de eletrofisiologia seja bastante comum, ela não é necessária para o registro de patch-clamp. Assim, para visualizar a amostra, uma técnica de aquisição para imagens sem marcação é geralmente empregada. Isso pode ser desafiador, uma vez que as amostras geralmente são bastante espessas (por exemplo, secções de cérebro com centenas de μm de espessura), o que causa dispersão da luz e limita a profundidade em que uma observação suficientemente detalhada pode ser realizada.
Embora as técnicas que não utilizam marcações, como microscopia de campo claro e contraste de fase, possam ser úteis para amostras mais finas, como culturas de células aderentes, elas não são adequadas para aquisição de imagens em secções de tecido espesso ou in vivo. O contraste de interferência diferencial (DIC) é uma opção devido à sua capacidade de seccionamento óptico, permitindo aquisição de imagens mais profundas e mantendo alta resolução (o DIC utiliza a abertura numérica total da lente objetiva).
Infelizmente, o DIC sozinho é muitas vezes insuficiente. Por esse motivo, a Nikon oferece DIC de infravermelho-próximo (IR-DIC), que usa iluminação de comprimento de onda no infravermelho-próximo (NIR) e componentes ópticos compatíveis. Em comparação com a luz visível, a luz NIR é capaz de penetrar mais profundamente nas amostras, graças aos comprimentos de onda mais longos, tornando possível a identificação de neurônios individuais em profundidades nas quais a luz visível de DIC falha.
Lentes objetivas para experimentos de eletrofisiologia
Para experimentos de eletrofisiologia, os microscópios geralmente são configurados com lentes objetivas de imersão em água – nas quais a ponta da lente é imersa diretamente no meio aquoso em que se encontra a amostra (sem necessidade de lamínula). As objetivas de imersão em água (Water Dipping) para eletrofisiologia geralmente têm pontas feitas de um material quimicamente inerte e eletricamente isolante, como a cerâmica. O fator forma da lente objetiva também é importante, sendo que a extremidade da objetiva deve ter um ângulo de aproximação íngreme em direção à ponta, para fornecer acesso máximo de micromanipuladores à amostra.
As lentes objetivas da série de imersão em água CFI60 da Nikon apresentam altos graus de correção de aberração e transmitância no NIR, o que as tornam adequadas para pesquisas em eletrofisiologia, especialmente em combinação com aquisição de imagem de IR-DIC ou multifóton. Todas as lentes objetivas CFI60 são compatíveis com IR-DIC, sendo que as lentes NIR 40X W e NIR 60X W apresentem um benefício adicional de transmissão aprimorada no NIR. A CFI Plan 100XC W possui um colar de correção para correção de aberrações esféricas.
As lentes objetivas da série de imersão em água CFI75 da Nikon incluem lentes de imersão em água com ampliação de 16X e 25X, que são fisicamente maiores do que as lentes CFI60, apresentando um tamanho de rosca de M32 e distância parfocal de 75 mm. O maior tamanho é requerido para acomodar a grande óptica necessária para coletar luz em um ângulo suficientemente amplo, que alcance ao mesmo tempo uma alta abertura numérica (NA) e uma distância de trabalho mais longa. A CFI75 LWD 16X W é uma escolha popular, considerada uma “solução de objetiva única”, com ampliações de 5,6X, 32X e 64X acessíveis por meio de porta dupla FN-DP e trocador de ampliação . A CFI75 Apochromat 25XC W 1300 é uma das objetivas mais brilhantes fabricadas pela Nikon, apresentando alta transmitância e correção de aberração até 1300 nm. Todas as lentes objetivas de imersão em água CFI75 também são compatíveis com IR-DIC.
Configuração de microscópio para eletrofisiologia e optogenética
A estimulação optogenética de células expressando atuadores optogenéticos de diferentes funcionalidades, como o canal de íon controlado por luz, a channelrodopsina-2 (ChR2), é um método comum para uma variedade de aplicações experimentais. Essa estimulação, em células neurais e musculares, é complementada pelo registro da atividade elétrica por meio da técnica de patch-clamp, que permite avaliar diretamente as conexões funcionais locais e de longo alcance de diferentes neurônios. A ativação elétrica é geralmente realizada utilizando uma iluminação padronizada a partir de um dispositivo de fotoestimulação.
O microscópio ECLIPSE FN1 pode ser configurado com um dispositivo de fotoestimulação de um único ponto, ajustável manualmente, ou com um dispositivo de microespelho digital (DMD). Os DMDs permitem a fotoativação de padrões de iluminação arbitrários com estrutura limitada por difração próxima. Isso permite o direcionamento preciso de estimulação de nível celular para subcelular, com padrões programáveis pelo usuário e taxas de comutação de até 4.000 Hz.
Glossário
- Ampliação do zoom
- A ampliação ou magnificacão do zoom em um microscópio de campo amplo é normalmente fornecida opticamente, por exemplo, com um acessório de troca de ampliação, que fornece um número predefinido de opções, como no microscópio FN1. Os sistemas confocais e multifóton de varredura pontual geralmente dependem do zoom de varredura, em que o zoom óptico é simulado pelo escaneamento de apenas uma pequena região, mantendo a alta resolução de pixels.
- Campo de visão
- O campo de visão do sistema, também conhecido como número do campo, é o diâmetro da área da imagem em uma ampliação normal de 1X.
- Limite relativo de profundidade da aquisição de imagem
- Isso indica a faixa de profundidade Z aproximada (axial) dentro da qual o sistema indicado pode fornecer imagens com bom seccionamento óptico e boa relação sinal-ruído. Esse valor pode ser bastante variável e depende muito das propriedades ópticas da amostra e do recipiente, bem como da marcação.
- Técnicas de contraste compatíveis
- Normalmente, os sistemas de microscópio utilizados em eletrofisiologia apresentam pelo menos uma técnica de luz transmitida, para suportar imagens sem marcação, como IR-DIC. Uma modalidade de imagem de fluorescência (campo amplo, confocal ou multifóton) também pode ser necessária para diferentes experimentos.
- Início
- Aplicações
- Ciências da vida
- Eletrofisiologia