- zh Change Region
- Global Site
纳米级成像
数百年来,光学显微镜的分辨率一直无法从根源上摆脱衍射极限的限制,~200纳米(nm)被认为是XY方向上分辨率的近似极限。对于单个细胞和许多亚细胞特征的观察而言,这一分辨率或许够用,但尚不足以分辨精细的亚细胞器级细节和单个生物分子,因其大小往往只有几纳米。
近期历史见证了各种“超分辨率”光学成像方法的诞生,这些方法运用不同的策略来规避衍射带来的限制。超分辨率的重要性最终被2014年诺贝尔化学奖所承认,且已在一些发现中作出了巨大贡献,如轴突周期性支架的结构。
纳米级成像产品
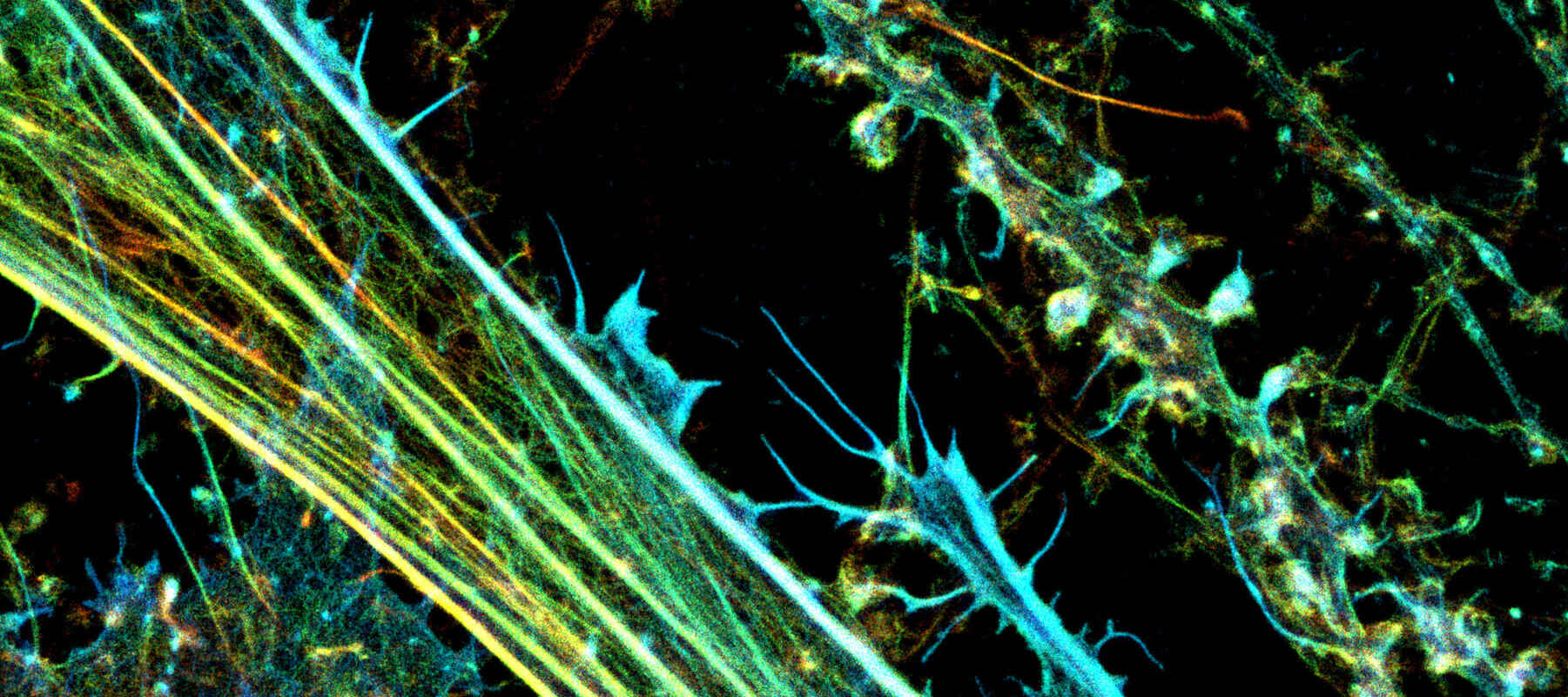
Christophe Leterrier教授利用尼康N-STORM系统获得的,具有荧光标记肌动蛋白(对深度进行了颜色编码)的神经元培养3D-STORM图像(CR1 CNRS)。
N-STORM超分辨率显微镜系统是尼康分辨率最高的系统,其XYZ方向上的分辨率比宽场落射荧光高约一个数量级。N-STORM配置在Ti2-E倒置显微镜上,后者凭借完美对焦系统4(PFS4)的对焦锁定系统确保高稳定性。该对焦系统也可用于Z-stacking STORM成像模式的精细轴向位移,实现最大~5 μm厚体积的成像。传统全内反射荧光(TIRF)成像也可使用N-STORM系统进行。
N-SIM S超分辨率显微镜系统使用空间光线调制器快速切换干涉图样,提高了9图(2D-SIM、TIRF-SIM)和15图(3D-SIM)模式的速度。9图SIM可在最高15帧/秒(FPS)的速率下进行,适合许多活细胞成像应用。除了具有TIRF显微术的光学切片功能外,TIRF-SIM还在XY方向上提供了额外的分辨率改善方案。N-SIM E超分辨率显微镜系统是一种用于3D-SIM成像的性价比更为理想的型号,提供了和N-SIM S系统相同的分辨率。
横河电机CSU-W1 SoRa超分辨率转盘式共聚焦系统是一种集成了发射微透镜盘,通过光学像素再分配实现超分辨率的转盘式共聚焦仪器。由于CSU-W1 SoRa采用转盘设计,因此图像采集速度很快。
●: 包含, ⚬: 选配
| N-STORM超分辨率显微镜系统 | N-SIM S超分辨率显微镜系统 | N-SIM E超分辨率显微镜系统 | 横河电机CSU-W1 SoRa超分辨率转盘式共聚焦系统 | |
|---|---|---|---|---|
| 相对光学分辨率限制 | ~20 nm (XY) * ~50 nm (Z) * |
~115 nm (XY)* ~86 nm (XY;TIRF-SIM模式)* ~269 nm (Z;3D-SIM模式)* |
~115 nm (XY)* ~269 nm (Z;3D-SIM模式)* |
~120 nm (XY) * |
| 相对成像深度限制 | ~ 5 μm | ~ 10 – 20 μm | ~ 10 – 20 μm | ~ 50 – 100 μm |
| 支持的图像采集速率 | ~0.1 FPS (最高500 Hz,采集单帧图像) |
~15 FPS (仅2D-SIM和TIRF-SIM) |
~1 FPS (all modes) |
~30+ FPS (仅受信噪比、转盘转速和相机读出速率限制) |
| 支持的光谱通道 | 3 | 6 | 3 | 6 |
| 最大图像采集区域 | 80×80 μm(使用100X物镜) | 66×66 μm(使用100X物镜) | 66×66 μm(使用100X物镜) | 61×57 μm(使用具有2.8X放大倍率透镜的100X物镜) |
| 兼容镜座 | N-STORM | N-SIM S | N-SIM E | CSU-W1 SoRa |
| ECLIPSE Ti2-E倒置显微镜 | yes | yes | yes | yes |
| ECLIPSE Ti2-A倒置显微镜 | no | no | no | yes |
| ECLIPSE Ti2-U倒置显微镜 | no | no | no | yes |
*所提供的均为近似值,仅供参考。分辨特性因具体条件不同而异。对于未预计改善的维度,不提供其分辨率估值。
相关文献
关于纳米级成像
选择最合适的超分辨率方法
使用3D-SIM的Z-stack进行定量树突棘分析,35步长,Z轴范围:4.2 um
曝光时间100 ms,间隔120秒
11次的延时成像
激发波长488 nm
样本信息:小鼠海马神经元表达GFP中的树突棘
视频来源:东京大学医学研究院和医学院细胞神经生物学系的YutaroKashiwagi博士和Shigeo Okabe博士
超分辨率成像技术提供了超越衍射限制的分辨率,但不同技术也有各自的局限性和取舍,只有充分了解这一点,才能找到最适合自身研究方向的超分辨率技术。
首先也是最重要的一点,超分辨率采集速率一般比传统技术慢。由于采集速率慢(采集一帧图像几乎普遍需要1秒以上),因此很难在活细胞中使用N-STORM成像。STORM和其他SMLM技术提供了最大的分辨率改善,但其兼容的荧光基团数量有限,其中很多都需要与活细胞不兼容的专用缓冲系统。
N-SIM S和横河电机CSU-W1-SoRa更适合超分辨率活细胞成像,因其支持更快的成像速率(N-SIM S的成像速率达15 FPS,CSU-W1-SoRa的成像速率则更高),可使用传统荧光基团而无需专门的缓冲系统。
超分辨率成像用的高性能物镜
安装在Ti2-E倒置显微镜上的尼康自动校正环物镜。
关于光学分辨率如何最大化的问题,关键因素之一是物镜选择。正如其他成像技术一样,这一点也适用于超分辨率成像。
确保合适的浸润介质的同时,物镜的数值孔径(NA)理应越高越好。尼康超分辨率系列显微镜物镜包括CFI SR HP Apochromat TIRF 100XC Oil(油浸,NA = 1.49)、CFI SR HP Plan Apochromat Lambda S 100XC Sil(硅油浸,NA = 1.35)和CFI SR Plan Apochromat IR 60XC WI(水浸,NA = 1.27)。这些物镜的数值孔径是同级别产品中最高的。
选择超分辨率系列物镜可配有一个自动校正环,无需手动调整即可十分精细地校正球面相差,确保最高水平的分辨率和3D成像表现。
增强分辨率:拓展传统技术的限制
耳蜗纤毛的点扫描共聚焦图像。应用(右)和没有应用(左)增强分辨率设置的XY及XZ视图。
有时,您真正需要的分辨率并不比传统分辨率高很多,所以不一定非要做出超分辨率方式所要求的某些取舍。这种情况下,建议您考虑一下我们称之为“增强分辨率”共聚焦成像的可能性。
何为增强分辨率共聚焦成像?理解它的关键在于传统共聚焦显微镜已在一定程度上提高了分辨率,使其超过使用典型宽场显微镜所能带来的分辨率提升,理论极限约为120 nm(XY)。然而,达到这一极限需要使用无穷小的针孔孔径。幸运的是,实际上可采用尺寸~0.5 AU的针孔与采集后3D迭代去卷积结合起来逼近这一极限, ~160 nm(XY)的分辨率是满足成像条件下的实际目标。
尼康AX / AX R点扫描共聚焦显微镜能够增强分辨率成像。其优点包括能够精确调节对大部分可见光荧光基团的探测并支持最多同时采集四个光谱通道。六边形(而不是正方形)针孔连续可变,可实现更精确的调整。使用AX R共振扫描共聚焦型显微镜不仅能提升分辨率,还能达到视频速率(30 FPS)甚至更快的成像速度。
词汇表
- 兼容镜座
- 指兼容各系统的尼康显微镜镜座。
- 支持的光谱通道
- 是指根据光谱(染料发出的颜色)支持的通道数量(假设每种类型荧光团对应一条激光)。
- 支持的图像采集速率
- 采集速率用帧/秒(FPS)表示。
- 最大图像采集区域
- 采用指定物镜放大系数的技术所支持的最大视野(在样本空间中测量)。
- 相对光学分辨率限制
- 指定系统的实际分辨率限制。横向(XY)分辨率一般与轴向(Z)分辨率不同。如未给出Z分辨率数值,则表示未提供该维度上的任何改进。
- 相对成像深度限制
- 表示指定系统在保证图像的光学切片质量和信噪比的前提下,成像的近似Z(轴)深度范围。该值可能相差很大,且与标本和容器以及荧光标记情况密切相关。